Lý thuyết về kim loại kiềm và hợp chất quan trọng của kim loại kiềm
Lý thuyết căn bản nào mà bạn cần nắm được trong bài kim loại kim loại kiềm và hợp chất của quan trọng của kim loại kiềm? Cunghocvui đã tổng hợp nên bài viết này, chỉ ra những lý thuyết căn bản giúp bạn dễ dàng nắm bắt kiến thức chính quan trọng trong bài học. Cùng học thôi.
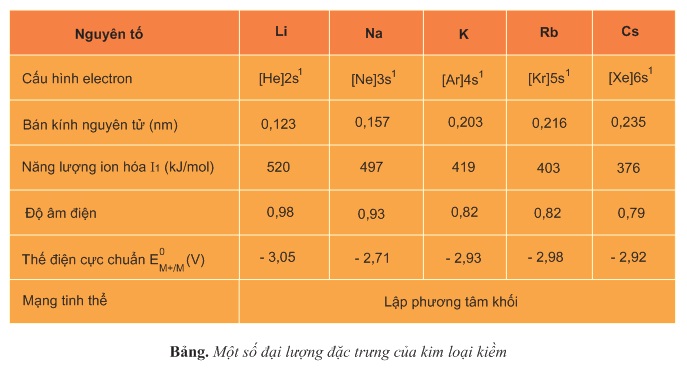
I) Kim loại kiềm là gì?
- Kim loại kiềm là những nguyên tố hóa học thuộc nhóm IA trong bản tuần hoàn.
- Nguyên tố là kim loại kiềm khi trong nguyên tử lớp ngoài cùng có I electron, ứng với cấu hình tổng quát là \(ns^1\)
♦ Lưu ý: Franxi tuy thuốc nhóm kim loại kìm nhưng vì nó là nguyên tố phóng xạ nhân tạo không bền nên trong chương trình học phổ thông không tìm hiểu.
II) Hợp chất của kim loại kiềm
1) Natri Hidroxit (NaOH)
- Là chất rắn màu trắng, hút ẩm mạnh, nhiệt độ nóng chảy tương đối thấp \(328^0C\). Tan tốt trong nước và rượt, trong quá trình tan tỏa nhiều nhiệt.
- NaOH là bazo mạnh (tên gọi khác: kiềm, chất ăn da) làm đổi màu chất chit thị: quỳ tím hóa xanh, phenolphtalein hóa hồng.
Cho NaOH vào trong nước thì chúng phân li hoàn toàn: \(NaOH \rightarrow Na^+ OH^-\)
NaOH có đầy đủ tính chất của một hidroxit là tác dụng với axit và oixt axit.
- Ứng dụng: Sản xuất xà phòng, giấy, tơ nhân tạo, tinh dầu thực vật và các sản phẩm chung cất dầu mở, chế phẩm dược phẩm nhuộm,...
2) Natri Hidrocacbonat và natri cacbonat
a) Natri hidrocacbonat (\(NaHCO_3\))
- Là tinh thể màu trắng, ít tan.
- Các phản ứng có ở \(NaHCO_3\) là phản ứng nhiệt phân, tác dụng với bazo, với axit và cả thủy phân.
- Ứng dụng: \(NaHCO_3\) được dùng trong y khoa chữa bênh dạ dày và ruột do thừa axit, khó tiêu, chữa chứng nôn mửa và giiar độc axit. Trong công nghiệp thực phẩm thì để sản xuất bột nở.
b) Natri cacbonat (\(Na_2CO_3\))
- Natri cacbonat (Soda) là chất bột màu trắng, hút ẩm và \(t^0_{nc} =851^0C\). Dễ tan trong nước và tỏa nhiều nhiệt.
- Xảy ra các phản ứng với axit, thủy phân.
- Ứng dụng: Là nguyên liệu dùng trong công nghiệp sản xuất thủy tinh, xà phòng, giấy dệt và điều chế muối khác. Giúp tẩy sạch vết mỡ bám trên những chi tiết máy trước khi sớn, tráng kim loại.
c) Natri Clorua (NaCl)
- NaCl là hợp chất rất phổ biến trong thiên nhiên (có trong nước biến, nước của hồ nước mặn, khoáng vật halit (muối mỏ). Kết tinh thành muối ăn sau khi đun nóng hoặc phơi nắng tự nhiên.
- Tính chất vật lí: Là hợp chất ion có dạng mạng lưới lập phương tâm diện, không có màu và hoàn toàn trong suốt. Nhiệt độ nóng chảy và nhiệt độ sôi cao, \(t^0_{nc} = 800^0C, t^0_s = 1454^0C\).
- Tính chất hóa học:
- Khác với các muối phía trên, NaCl không phản ứng với kim loại ,axit, bazow ở điều kiện thường.
- Ở trạng thái rắn, NaCl phản ứng với \(H_2SO_4\) đậm đặc. Tuy nhiên hiện nay rất ít dùng vì tạo ra nhiều khí độc hại, gây nguy hiểm tới hệ sinh thái, ô nhiễm môi trường.
- Ngoài ra NaCl còn có phản ứng điện phân dung dịch.
- Ứng dụng: Là nguyên liệu điều chế Na, HCl, NaOH và hầu hết các hợp chất quan trọng khác của natri. Ngoài ra còn được dùng nhiều trong các ngành công nghiệp thực phẩm, nhuộm, luyện kim,...
III) Tính chất vật lí
Vì các kim loại kiềm có cấu tạo mạng tinh thể lập phương tâm khối nên nó là kiểu mạng kém bền vững và không đặc khít.
Tính chất vật lí đặc trưng:
- Lực liên kết kim loại trong mạng tinh thể kim lọai kiềm yếu nên nhiệt độ nóng chảy, nhiệt độ sôi thấp, giảm dần từ Li đến Cs.
- Nhiệt độ nóng chảy của kim loại kiềm đều thấp hơn \(200^0C\).
- Nguyên tử của các kim loại kiềm có bán kính nguyên tử lớn và có cấu tạo mang tinh thể kém và đặc khít nên khối lượng riêng của chúng nhỏ.
- Lực liên kết kim loại trong mạng tinh thể của kinh loại kiềm yếu nên độ cứng thấp, có thể cắt chúng bằng dao.
Có thể bạn quan tâm: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
IV) Tính chất hóa học
- Các nguyên tử của kim loại kiềm đều có năng lượng ion hóa \(I_1\) thấp và thế điện cực chuản có giá trị rất âm. Bởi vậy nên kim loại kiềm là chất khử manh nhất trong số các kim loại.
- Chỉ số oxi hóa của kim loại kiềm là +1
- Phương trình khử: \(M \rightarrow M^+ + 1e\)
Xét phương trình phản ứng hóa học của natri.
1) Tác dụng với phi kim
Cho Na tác dụng với \(O_2\):
\(4Na + O_2 \rightarrow 2Na_2O\)
Ta thấy được Natri khử dễ dàng nguyên tử phi kim thành ion âm
2) Tác dụng với nước
Phương trình phản ứng:
\(2Na + 2H_2O \rightarrow 2NaOH + H_2\)
Khi cho Natri hay một kim loại kiềm nào khác tác dụng với nước thì phản ứng mạnh ngay ở nhiệt độ thường, đây là tính chất hóa học đặc trưng nhất chỉ có ở kim loại kiềm và kiềm thổ.
3) Tác dụng với axit
Cho natri tác dụng với HCl:
\(2Na +2HCl \rightarrow 2NaCl + H_2\)
trong trường hợp cho natri dư thì sẽ tạo thêm phản ứng:
\(2Na(dư) +2H_2O \rightarrow 2NaOH + H_2\)
Qua hai phản ứng ta thấy được khi ở điều kiện nhiệt độ thường thì các kim loại kiềm cũng phản ứng mãnh liệt với axit. Viết phương trường phản ứng ta ưu tiên viết phương trình kim loại kiềm tác dụng với dung dịch axit trước, sau đó nếu axit thiếu thì kim loại kiềm dư sẽ phản ứng với nước.
4) Tác dụng với dung dịch muối
Phản ứng qua giai đoạn:
\(2Na +2HCl \rightarrow 2NaCl + H_2\)
\(FeCl_2 + 2NaOH \rightarrow Fe(OH)_2 (kt) + 2NaCl\)
hiện tượng xuất hiện ở đây là sủi bọt khí và tạo kết tủa.
♦ Lưu ý:
- Kim loại kiềm không đẩy kim loại yếu hơn ra khỏi dung dịch muối
- Để bảo vệ kim loại kiềm, người ta ngâm chìm các kim loại kiềm trong dầu hỏa nhằm ngăn cản không cho tác dụng với \(O_2\), \(H_2O\) của không khí.
V) Bài tập kim loại kiềm
Bài tập 1: Hòa tan hoàn toàn m(g) một kim loại kiềm vào 96,48(g) nước, thu được 100g dung dịch X và 1,972 lít \(H_2\) (ddktc). Xác định tên kim loại kiềm và nồng độ phần trăm của dung dịch X.\
Đ/A: Na, \(6,4\)%
Bài tập 2: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm là?
A. \(ns^1\)
B. \(ns^2\)
C. \(ns^3\)
D. \(ns^4\)
Đ/A: B
Bài tập 3: Kim loại kiềm hóa trị mấy?
A. \(I\)
B. \(II\)
C. \(III\)
D.
Đ/A: A
Xem thêm >>> Bài tập SGK
Trên đây là bài viết tổng hợp lý thuyết căn bản trong bài kim loại kim loại kiềm và hợp chất của quan trọng của kim loại kiềm, hy vọng bài viết sẽ giúp ích được nhiều cho các bạn trong quá trình học tập. Cùng comment thắc mắc và đáp án chi tiết bài tập kim loại kiềm ở phía trên nhé! Chúc bạn học tập tốt <3

