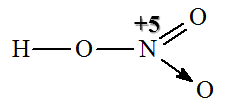Bài giảng Axit nitric và Muối nitrat - Hóa học 11
Bài giảng Axit nitric và Muối nitrat - Hóa học 11
Bài viết hôm nay Cunghocvui xin giới thiệu với các bạn về lý thuyết axit nitric và muối nitrat lớp 11!
I. Lý thuyết
1.1. AXIT NITRIC
1.1.1. Cấu tạo phân tử
Hình 1: Công thức cấu tạo HNO3
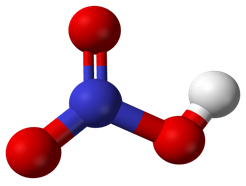
Hình 2: Mô hình phân tử HNO3
1.1.2. Tính chất vật lí
- Tồn tại ở dạng chất lỏng, không màu, không vị.
- Kém bền và dễ dàng bị phân hủy ngay ở cả điều kiện thường và tạo thành dung dịch có màu vàng nhẹ.
Hình 3: Sự phân hủy HNO3 dưới tác dụng của ánh sáng
- Tan được trong nước
- Photpho
- Axit photphoric và muối photphat
1.1.3. Tính chất hóa học
- Tính axit: là axít mạnh
- Quỳ tím hoá đỏ
- Phản ứng tác dụng với bazo và các oxit bazo tạo ra các muối có gốc nitrat.
\(2HNO_3 + CuO → Cu(NO_3)_2 + H_2O\)
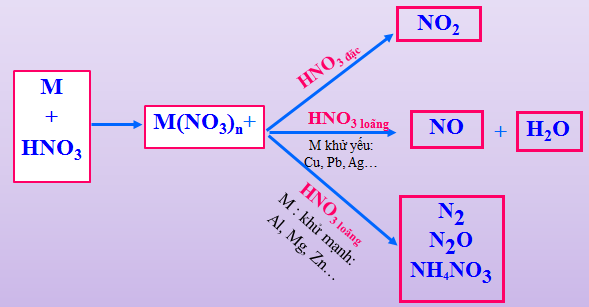
- Tính oxi hoá: Có khả năng tác dụng với kim loại, phi kim và các hợp chất.
1.2. MUỐI NITRAT
1.2.1. Tính chất vật lí
Là các chất điện li và tan mạnh trong môi trường nước.
\(Ca(NO_3)_2 → Ca ^{2+} + 2NO3^-\)
1.2.2. Tính chất hoá học
Là chất kém nhiệt và dễ xbij phân hủy ở điều kiện thường.
Các sản phẩm phân hủy của muối nitrat:
- KL trước Mg
muối Nitrit + O2
-
KL Mg đến Cu
Oxit kim loại + NO2 + O2
-
KL sau Cu
Kim loại + NO2 + O2
II. Sơ đồ tư duy bài axit nitric và muối nitrat
III. Bài tập axit nitric và muối nitrat
Hỗn hợp bao gồm: FeS2 và MS với số mol như nhau. 6,51g X + dd HNO3 dư, đun nóng A và 13,216 lít khí B (đktc) - 26,34 g gồm NO2 và NO. Cho A + dd BaCl2 dư tạo chất kết tủa: (Dùng cho câu 1, 2, 3, 4, 5)
Câu 1: Kim loại M là
A. Mg. B. Zn. C. Ni. D. Ca
Câu 2: Giá trị của m là
A. 20,97. B. 13,98. C. 15,28. D. 28,52.
Câu 3: Phần trăm khối lượng của FeS2 trong X là
A. 44,7%. B. 33,6%. C. 55,3%. D. 66,4%.
Câu 4: Phần trăm thể tích của NO trong X là
A. 50%. B. 40%. C. 30%. D. 20%.
Câu 5: Giá trị của a là
A. 23,1. B. 21,3. C. 32,1. D. 31,2.
Trên đây là toàn bộ kiến thức mà Cunghocvui muốn chia sẻ về nội dung cần nhớ và cách giải bài tập hóa axit nitric và muối nitrat lớp 11!