Lý thuyết Crom và hợp chất của Crom
Lý thuyết Crom và hợp chất của Crom
Bài viết hôm nay Cunghocvui xin giới thiệu với các bạn về lý thuyết và bài tập về crom và hợp chất của crom!

I. Lý thuyết chung
1. Định nghĩa
- Kí hiệu của nguyên tử Crom: 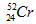
- Cấu hình electron:\(1s^22s^22p^6 3s^23p^6 3d^54s^1 \) như thế Crom thuộc họ kim loại chuyển tiếp bậc 1 ở chu kì 4 và phân nhóm VIB. Khi bị kích thích tức là khi tham gia phản ứng các electron no \(3d^5\ và \ 4s^1.\)
2. Tính chất vật lý:
Crom là kim loại rất cứng.
3. Tính chất hóa học của crom:
- Trong không khí, crom rất dễ bị oxi hóa tạo thành màng thụ động \(Cr_2O_3 \) che kín bề mặt của crom nên crom khó có phản ứng với các chất khác khi ở nhiệt độ thấp.
- Nhưng khi nung nóng, màng thụ động bị phá vỡ Crom có tính khử khá mạnh.
4. Ứng dụng của Crom
Crom được ứng dụng nhiều trong sản xuất công nghiệp và chế biến vật liệu xây dựng.
5. Một số hợp chất của Crom
5.1. Hợp chất Crom (II)
+ CrO:
+2 +3
\( 4 CrCl_2 + O_2 + 4HCl → 4CrCl_3 + 2H_2O\)
+2 +3
\( 4Cr(OH)_2 +O_2 + 2H_2O→ 4Cr(OH)_3\)
Dung dịch CrCl2 để ngòai không khí lại chuyển từ màu xanh lam sang màu lục
- \(CrCl_2\) trong dung dịch phân ly ra \(Cr^{2+} \ và \ Cl^-\). Ion \(Cr^{2+}\) tồn tại ở dạng \([ Cr(H_2O) ]^{2+}\) có màu xanh, nên dung dịch \(CrCl_2\) có màu xanh.
Mặt khác trạng thái oxi hóa +2 của Cr có tính khử mạnh ,ngay trong dung dịch \(CrCl_2\) bị oxi hóa bởi oxi không khí chuyển thành \(CrCl_3\) . Ion \(Cr^{3+}\) trong dung dịch tồn tại duới dạng \([ Cr(H_2O) ]^{3+}\) có màu lục.Nên trong không khí \(CrCl_2\) chuyển từ màu xanh lam sang màu lục .
+ \(Cr(OH)_2\)
- \(Cr(OH)_2\) có tính khử, trong không khí oxi hóa thành \(Cr(OH)_3\)
- \(Cr(OH)_2\) là một bazơ.
+ Muối crom (II): tính khử rất mạnh
5.2. Hợp chất Crom (III)
+ \(Cr_2O_3\)
- \(Cr_2O_3\) có cấu trúc tinh thể, mu lục thẫm, có nhiệt độ nóng chảy cao( 22630C)
- \(Cr_2O_3\) là oxit lưỡng tính, tan trong axit và kiềm đặc.
+ \(Cr(OH)_3\)
- \(Cr(OH)_3\) là hiroxit lưỡng tính, kết tủa nhầy, màu lục nhạt, tan được trong dung dịch axit và dung dịch kiềm.
- Bị phân huỷ bởi nhiệt tạo oxit tương ứng :
\( 2Cr(OH)_3 → Cr_2O_3 + 3H_2O\)
+ Muối crom (III)
- Muối Cr(III): \(CrCl_3\) màu tím, \(Cr_2(SO_4)_3\) màu hồng.
Chú ý: khi vào dung dịch, muối Cr(III) có màu tím-đỏ ở nhiệt độ thường và màu lục khi đun nóng.
- Trong môi trường axit, muối crom (III) có tính oxi hóa bị Zn khử thành muối crom (II)
- Trong môi trường kiềm, muối crom (III) có tính khử và bị chất oxi hóa mạnh oxi hóa thành muối crom (VI).
5.3. Hợp chất Crom (VI)
+ \(CrO_3\)
+ Muối cromat và đicromat
- Ion cromat \(CrO_4^{2-}\) -có màu vàng.
- Trong môi trường kiềm đicromat.(màu da cam), chuyển hóa thành cromat (màu vàng)
- Muối cromat và đicromat có tính oxi hóa mạnh, chúng bị khử thành muối Cr(III).
Giải bài tập - Bài 34. Crom và hợp chất của Crom
II. Bài tập trắc nghiệm crom và hợp chất của crom
Câu 1: Chọn phản ứng sai?
\(A. 2Cr + 3F_2 → 2CrF_3 \)
\(B. 2Cr + 3Cl_2 →2CrCl_3 \)
\(C. Cr+ S →CrS \)
\(D. 2Cr + N_2→2CrN\)
Câu 2: Chọn phản ứng sau đây không thỏa mãn lý thuyết về crom?
\(A. 2CrO_3 + 2NH_3 →Cr_2O_3 + N_2 + 3H_2O. \)
\(B. 4CrO_3 + 3C →2Cr_2O_3+ 3CO_2. \)
\(C. 4CrO_3 + C_2H_5OH →2Cr_2O_3 + 2CO_2 + 3H_2O. \)
\(D. 2CrO_3 + SO_3 →Cr_2O_7 + SO_2.\)
Câu 3: Thực hiện phản ứng gồm có 0,02 mol NaOH tác dụng hoàn toàn với dung dịch gồm có 0,01 mol \(CrCl_2\) để cho phản ứng xảy ra ở điều kiện hoàn toàn bình thường cho đến khi kết tủa xuất hiện và có khối lượng thu được là:
A. 1,03 gam
B. 2,06 gam
C. 1,72 gam
D. 0,86 gam
Trên đây là toàn bộ kiến thức mà Cunghocvui muốn chia sẻ về các lý thuyết quan trọng và giải bài tập crom và hợp chất của crom!

