Quá trình của phản ứng Oxi Hóa Khử và bài tập cân bằng phương trình
Quá trình của phản ứng Oxi Hóa Khử và bài tập cân bằng phương trình
Phản ứng oxi hóa - khử được coi là hai phản ứng hóa học đặc trưng có thể thấy ở hầu hết các nghiên cứu hóa học hay trong bài giảng. Chính vì vậy, những phản ứng này rất đa dạng, hôm nay cùng học vui sẽ giúp các bạn tổng hợp nên các kiến thức quan trọng nhé!
I. Phản ứng oxi hóa khử là gì?
Là phản ứng hóa học mà tại đó các electron bị chuyển giao trạng thái sau các phản ứng oxi hóa hay phản ứng khử, phản ứng xảy ra giữa các đối tượng hóa học và trong điều kiện nhiệt độ và chất xúc tác hợp lý.
Ví dụ:
\(C+O_2\rightarrow CO_2\\C+2H_2\rightarrow CH_4\)
Trong đó:
- Sự tăng trạng thái oxy hóa hoặc sự mất đi các điện tử gây ra bởi một phân tử, ion hoặc nguyên tử là quá trình oxi hóa,
- Sự giảm trạng thái oxy hóa hoặc tăng thêm các điện tử gây ra bởi một phân tử, ion hoặc nguyên tử là quá trình khử.
Tác dụng:
- Dùng trong điều chế ra các chất mới
- Phản ứng dùng trong các phản ứng thí nghiệm, nghiên cứu khao học.
- Dùng trong nghiên cứu y học.
Xem thêm:
II. Phản ứng oxi hóa khử giữa các chất
- Phản ứng oxi hóa
Là sự mất đi điện tử trong các chất, tính oxi hóa được tăng lên.
Một số chất oxi hóa mạnh như \( H_2O_2, MnO^{−4}, CrO_3, Cr_2O_2^{−7}, OsO_4 NO^{−3}, SO_2^{−4},...\) hoặc các chất mang trong mình độ âm điện cao ví dụ như \(O_2, F_2, Cl_2, Br_2 \)nên dễ lấy được các điện tử bằng cách oxy hóa chất khác.
- Phản ứng khử
Là sự tăng lên điện tử trong chất, tính khử được tăng lên rõ rệt.
Chất khử rất đa dạng một trong số đó có thể kể đến như các kim loại mạnh: Li, Na, Mg, Fe, Zn, Al...Bên cạnh đó, H2 được xem như một chất khử rất mạnh và xuất hiện rất nhiều trong các phản úng khử, điều chế.
- Các dạng thường gặp
- Dạng cơ bản:
\(Al + 6HNO_3 → Al(NO_3)_3 + 3NO_2 + 3H_2O\\1x (Al^0 – 3e → Al^{+3})\\3x (N^{+5} + 1e → N^{+4})\)
- Dạng phản ứng nội phân tử (phản ứng chỉ xảy ra trong một phân tử):
\(2KClO_3 →2KCl + 3O_2 \\2x (Cl^{+5} + 6e → Cl^{-1}) \\3x (2O^{-2} – 4e → O_2^0)\)
- Phản ứng tự oxi hóa khử (Sự tăng giảm số oxi hóa xảy ra chỉ trên 1 nguyên tố):
\(2Cl_2 + 4NaOH → 2NaCl + 2NaClO+ 2H_2O \\1x (Cl_2^0 + 2e → 2Cl^-) \\1x (Cl_2^0 – 2e → 2Cl^{+1})\)
- Phản ứng oxi hóa khử phức tạp:
\(3R + 4nHNO_3 → 3R(NO_3)_n + nNO + 2nH_2O \\3. (R^0 – ne → R^{+n}) \\n. (N^{+5} + 3e→ N^{+2})\)
III. Bài tập cân bằng phản ứng oxi hóa khử
Bài 1: Tìm phản ứng oxi hóa - khử?
- \(NH_3 + O_2 \rightarrow N_2 + H_2O\)
- \(H_2S + O_2 \rightarrow SO_2 + H_2O\)
- \(H_2S + NaOH \rightarrow Na_2S + H_2O\)
- \(NH_3 + HCl \rightarrow NH_4Cl\)
- \(H_2S + Cl_2 + H_2O \rightarrow H_2SO_4 + HCl\)
- \(HNO_3 + Mg \rightarrow Mg(NO_3)_2 + NO + H_2O\)
- \(H_2SO_4 + BaCl_2 \rightarrow BaSO_4 + HCl\)
- \(NH_3 + O_2 \rightarrow NO + H_2O\)
- \(Fe_xO_y + Al \rightarrow Fe + Al_2O\)
- \(CaO + H_2O \rightarrow Ca(OH)_2\)
- \(CaCO_3 + HCl \rightarrow CaCl_2 + CO_2 + H_2\)
- \(SO_3 + H_2O \rightarrow H_2SO_4\)
- \(CO_2 + Ca(OH)_2 \rightarrow CaCO_3 + H_2O\)
- \(KMnO_4 \rightarrow K_2MnO_4 + MnO_2 + O_2\)
- \(Ca + H_2O \rightarrow Ca(OH)_2 + H_2\)
Bài 2: Hoàn thiện và cân bằng các phản ứng sau:
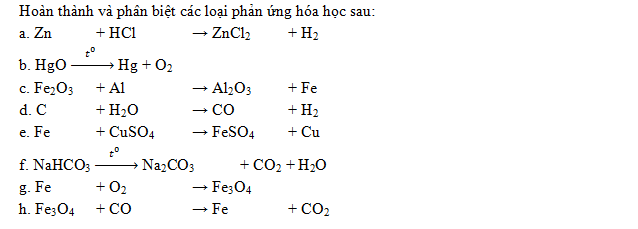
Luyện tập: Phản ứng oxi hoá - khử
Học tốt hóa học qua các phản ứng oxi hóa - khử cũng là một sáng kiến khá hay đó, nhớ ghi nhớ những kiến thức quan trọng này nhé và đừng quên cùng học vui còn có rất nhiều bài giảng thú vị cần bạn khám phá nữa đấy!

