Nắm trọn kiến thức lý thuyết sự điện li chuẩn nhất
Đi vào tìm hiểu những kiến thức cần nhớ và nắm được về sự điện li cùng với Cunghocvui. Trong bài viết bạn sẽ được tìm hiểu về những kiến thức như sự điện li là gì, phương trình điện li, chất điện li mạnh - chất điện li yếu, hằng số điện li và bài tập sự điện li.
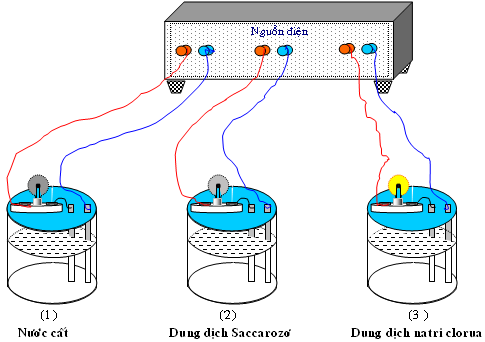
I) Sự điện li
1) Khái niệm sự điện li là gì?
Quá trình phân li của các chất trong môi trường nước hoặc chất ở trạng thái nóng chảy tạo ion là sự điện li.
2) Phân loại chất điện li
2.1) Khái niệm
Chất tan trong nước phân li ra ion được gọi là chất điện li. Chất điện li gồm chất điện li mạnh và chất điện li yếu.
2.2) Phân loại
a) Chất điện li mạnh: khi tan trong nước các phân tử hòa tan đều phân li ra ion và phương trình điện li chỉ dùng mũi tên một chiều.
VD:
\(NaOH \rightarrow Na^+ + OH^-\)
b) Chất điện li yếu: khi tan trong nước chỉ có một số phân tử phân li ra ion, phương trình điện li dùng mũi tên hai chiều.
VD:
\(HCOOH \rightleftharpoons H^+ + HCOO^-\)
2.3) So sánh chất điện li mạnh - chất điện li yếu
| Chất điện li mạnh | Chất điện li yếu | |
| Giống | - Đều tan trong nước - Phân li ra ion khi hòa tan | |
| Khác | - Khi hòa tan, các phân tử đều phân li ra ion. - Gồm: axit mạnh, bazo mạnh, muối tan - Trong phương trình điện li dùng mũi tên một chiều. | - Khi hòa tan, chỉ có một số phân tử phân li ra ion. - Gồm: axit yếu, bazo yếu, muối ít tan. - Trong phương trình điện li dùng mũi tên hai chiều. |
VD:
- \(NH_4Cl\) là chất điện li mạnh.
- \(HClO\) là chất điện li yếu.
3) Hằng số điện li
Tại đây ta xét hắng số điện li của axit và bazo yếu. Sự điện li của chúng không hoàn toàn nên phương trình điện li thuận nghịch.
- Với axit yếu
\(K_a = \dfrac {\left [ H^+ \right ]^n\left [ A^{-n} \right ]}{\left [ H_nA \right ]}\)
- Với bazo yếu
\(K_a = \dfrac {\left [ CH_3-NH_3^+ \right ]^n\left [ OH^- \right ]}{\left [ CH_3-NH_2 \right ]}= 4,4.10^-4\)
Suy ra ta có công thức tính hằng số điện li tổng quát như sau:
\(K_a = \dfrac {\left [ A^{n}+ \right ]^n\left [ B^{m+} \right ]^b}{\left [ A_aB_b \right ]}\)
Trong đó:
- \(\left [ A^{n+} \right ]\): nồng độ \(A^{n+} \) tại TTCB (trạng thái cân bằng).
- \(\left [ B^{m+} \right ]\): nồng độ \(B^{m+} \) tại TTCB.
- \(\left [ A_aB_b \right ]\): nồng độ \(A_aB_b\) tại TTCB.
- \(a.n = b.m\)
II) Luyện tập
Sau đây là một số bài tập sự điện li (chuyên đề sự điện li có đáp án) mà Cunghocvui đã tổng hợp được, hy vọng những bài tập dưới đây sẽ giúp ích được nhiều cho bạn.
Câu 1: \(H_2S \) là chất điện li mạnh hay yếu?
A. Chất điện li mạnh
B. Chất điện li yếu
C. Vừa mạnh vừa yếu
D. Không xác định
Chọn B
Câu 2: Cho các phân tử, ion sau: \(HI, HSO_3^-, H_2PO_4^-, PO_4^3-, NH_3, S^{2-}, HPO_4^2-\). Hỏi có bao nhiêu phân tử, ion lưỡng tính?
A. 1
B. 2
C. 3
D. 4
Chọn C
Câu 3: \(HClO_4\) là?
A. axit yếu
B. chất điện li mạnh
C. chất điện li yếu
D. Tất cả.
Chọn B
Câu 4: Chọn đáp án đúng khi nói về dãy các chất và ion đều là axit.
A. \(HNO_3, HCOOH, Mg^{2+}\)
B. \(NaOH, Mg ^{2+}, KOH\)
C. \(Al^{3+}, Zn^{2+}, CO_3^{2-}\)
D. \(H_2CO_3, CO_3^{2-}; HCl\)
Chọn A
Câu 5: Dung dịch nào dưới đây làm quỳ tím hóa đỏ?
A. \(FeCl_3\)
B. \(NH_4Cl\)
C. \(AlCl_3\)
D. A, B và C
Chọn D.
Xem thêm >>> Giải bài tập SGK
Trên đây là bài viết Cunghocvui tổng hợp kiến thức về sự điện li mà bạn cần nắm được trong bài, mong rằng sau bài viết bạn sẽ nắm chắc được sự điện li là gì, chất điện li manh - chất điện li yếu, phương trình điện li, hằng số điện li và bài tập sự điện li. Chúc bạn học tập tốt <3

