Lý thuyết và thực hành tính chất hóa học của oxit và axit
Lý thuyết và thực hành tính chất hóa học của oxit và axit
Oxit là một công thức hóa học rất phổ biến và quan trọng. Chúng hầu như xuất hiện rất nhiều trong các đề kiểm tra cũng như đề thi hóa học. Để ghi nhớ được các hợp chất quan trọng mời các bạn cùng theo dõi bài viết dưới đây!
I. Lý thuyết chung
1. Công thức tổng quát của oxit?
Oxit được tạo nên từ một nguyên tố có thể là kim loại hoặc phi kim, kết hợp với một nguyên tố oxi.
Công thức tổng quát: \(M_xO_y\)
Ví dụ một số oxit quan trọng:
- Natri oxit: \(Na_2O\)
- Canxi oxit: \(CaO\)
- Kẽm oxit: \(ZnO\)
- Nhôm oxit: \(Al_2O_3\)
- Oxit sắt từ: \(Fe_2O_3\)
Công thức liên quan:
2. Phân dạng oxit
- Oxit axit
Là hơp chất được cấu tạo từ nguyên tố phi kim và nguyên tố oxi, phản ứng với bazo tạo ra muối và nước, phản ứng với nước tạo thành 1 axit.
Ví dụ: Nito oxit: \(NO_2\), Cacbon oxit: \(CO_2\), \(Mn_2O_7, CO_2 - H_2CO_3, P_2O_5 - H_3PO_4..\)
- Oxit bazo
Là hợp chất tác dụng với axit tạo thành muối và nước. Một số tác dụng với nước tạo thành bazo tan gọi là kiềm.
Ví dụ: \(Na_2O - NaOH, Fe_2O_3 - Fe(OH)_3...\)
- Oxit trung tính
Không tạo ra phản ứng với nước để tạo bazơ hay axit, không phản ứng với bazơ hay axit để tạo muối.
Ví dụ:NO, CO,...
- Oxit lưỡng tính
Có khả năng vừa tác dụng với cả axit và bazo để tạo ra nước và muối tương ứng.
Ví dụ: \( Al_2O_3,ZnO\)
II. Tính chất hóa học của oxit
- Tác dụng với \(H_2O\)
Oxit axit tác dụng với nước tạo axit (\(trừ \ SiO_2\)).
Ví dụ:
\( {\displaystyle { {SO_3 +H_2O \rightarrow H_2SO_4}}}\)
\({\displaystyle { {P_2O_5 +3H_2O \rightarrow 2H_3PO_4}}}\)
Một số tác dụng với nước tạo thành bazơ. Chỉ có các oxit bazơ của kim loại kiềm \((Li,Na,K,Rb,...)\) và kiềm thổ \( (Ca,Ba,Sr,...)\) ngoại trừ Be và Ma kết hợp với nước sẽ tạo thành bazơ \((CaO, Na_2O, Li_2O, BaO, K_2O)\)
Ví dụ:
\({\displaystyle {{CaO +H_2O \rightarrow Ca(OH)_2}}}\)
\({\displaystyle { {BaO +H_2O \rightarrow Ba(OH)_2}}}\)
- Tác dụng với axit
Chỉ có oxit bazo mới phản ứng tạo muối và nước
Ví dụ: \({\displaystyle { {3CaO +2H_3PO_4 \rightarrow Ca(PO_4)_2 +3H_2O}}}\)
- Tác dụng với bazo
Chỉ có oxit axit mới phản ứng tạo muối và nước
Ví dụ: \({\displaystyle { {SO_3 +2NaOH \rightarrow Na_2SO4 +H_2O}}}\)
Oxit lưỡng tính cũng có thể tác dụng với bazơ tạo sản phẩm là muối và nước.
Ví dụ: \({\displaystyle {{Al_2O+3 +2NaOH \rightarrow 2NaAlO_2 +H_2O}}}\)
-
Tác dụng với oxit
5 loại đặc biệt: \(Li_2O, K_2O, BaO, CaO, Na_2O\) có thể phản ứng với oxit axit tạo thành muối
Ví dụ:
\({\displaystyle { {CaO +CO_2 \rightarrow CaCO_3}}}\)
\({\displaystyle { {BaO +CO_2 \rightarrow BaCO_3}}}\)
III. Luyện tập tính chất hóa học của oxit và axit

Bài 2: Khi hoà tan một lượng của một oxit kim loại hoá trị II vào một lượng vừa đủ dung dịch axit \(H_2SO_4 \ 4,9\%\), người ta thu được một dung dịch muối có nồng độ 5,78%. Xác định công thức oxit trên.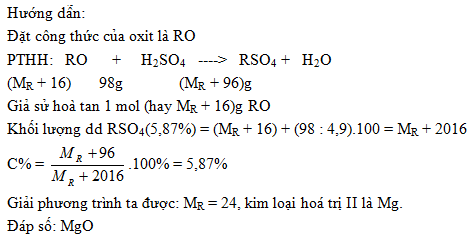
Thông qua bài học vừa rồi chắc hẳn các bạn đã tự đưa ra lời giải cho bản thân mình rồi đúng không. Nếu còn thắc mắc hay tài liệu thú vị về chủ đề này, hãy cho chúng tôi biết nhé! Cảm ơn sự quan tâm của các bạn!

