Tổng hợp đầy đủ lý thuyết về amin vô cùng quan trọng không nên bỏ qua
AMIN
Trong bộ môn Vật lý 12, các em học sinh sẽ được học chủ đề Amin, đây là chủ đề rất quan trọng. Bài viết dưới đây cunghocvui.com sẽ tổng hợp kiến thức quan trọng về chủ đề này.
I. Lý thuyết
1. Khái niệm
- Amin là hợp chất hữu cơ được tạo ra khi thế một hay nhiều nguyên tử hidro trong phân tử amoniac bằng một hoặc nhiều gốc hidrocacbon.
Ví dụ: \(CH_3 - NH_2\), \(CH_3 - NH - CH_3\)...
- Công thức tổng quát amin:
\(C_xH_yN_z\) (x, y, z thuộc N*; y \(\leq \) 2x + 2 + z; y chẵn nếu z chẵn; y lẻ nếu z lẻ).
hoặc \(C_nH_{2n+2-2k+t}N_t\) (n thuộc N*; k thuộc N; t thuộc N*).
Số liên kết pi + số vòng trong phân tử amin = \(\frac{2x + 2 + t - y}{2}\).
Nếu là amin bậc 1 thì công thức tổng quát có thể là: \(C_nH_{2n+2-2k-t}(NH_2)_t\).
2. Phân loại
a) Theo cấu tạo gốc hidrocacbon
- Amin mạch hở như: \(CH_3NH_2, C_2H_5NH_2\)...
- Amin thơm như: \(C_6H_5NH_2\), \(CH_3C_6H_4NH_2\)...
b) Theo bậc của amin
Bậc amin thường được tính bằng số gốc hidrocacbon liên kết nguyên tử nitơ.
- Amin bậc 1 như: \(C_2H_5NH_2\)
- Amin bậc 2 như: \(CH_3-NH-CH_3\)
- Amin bậc 3 như:
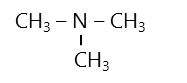
3. Danh pháp
- Gọi tên theo danh pháp gốc - chức: ank + yl + amin.
- Gọi tên theo danh pháp thay thế: ankan + vị trí + amin.
- Tên thông thường chỉ áp dụng với một số amin.
*Chú ý:
- Tên các nhóm ankyl đọc theo thứ tự chữ cái a, b, c...
- Với các amin bậc hai và ba, chọn mạch dài nhất chứa N làm mạch chính, N có chỉ số vị trí nhỏ nhất. Đặt một nguyên tử N trước mỗi nhóm thế của amin. Khi nhóm \(-NH_2\) đóng vai trò nhóm thế thì gọi là nhóm amino.
Ví dụ: \(CH_3CH(NH_2)COOH \) (axit 2-aminopropanoic).
4. Đồng phân
- Đồng phân về mạch cacbon.
- Đồng phân vị trí nhóm chức.
- Đồng phân về bậc amin.
5. Tính chất vật lý
- Metylamin, đimetylamin, trimetylamin, etylamin là những chất khí, mùi khai, tan nhiều trong nước.
- Các amin có phân tử khối cao hơn là những chất lỏng hoặc rắn, nhiệt độ sôi tăng dần và độ tan trong nước giảm dần theo chiều tăng phân tử khối.
- Các amin thơm là chất lỏng hoặc chất rắn và dễ bị oxi hóa.
- Các amin đều độc.
6. Cấu tạo phân tử và tính chất hóa học
a) Cấu tạo phân tử
Trong phân tử amin, nguyên tử N tạo được một, hai hoặc ba liên kết với gốc hidrocacbon, tương ứng có amin bậc một \(RNH_2\), amin bậc hai \(R-NH-R^1\), amin bậc ba:
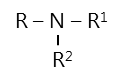
=> Phân tử amin có nguyên tở nitơ tương tự trong phân tử \(NH_3\) nên các amin có tính bazơ. Ngoài ra, amin còn có tính chất của gốc hidrocacbon.
b) Tính chất hóa học
- Tính bazo của amin:
Thí nghiệm: Nhúng giấy quỳ tím vào dung dịch metylamin hoặc propylamin, màu quỳ tím chuyển thành xanh. Nếu nhúng quỳ tím vào dung dịch anilin, màu quỳ tím không đổi.
Giải thích: Metylamin và propylamin cũng như nhiều amin khác khi tan trong nước phản ứng với nước tương tự \(NH_3\) sinh ra ion \(OH^-\).
\(CH_3NH_2+H_2O \rightleftharpoons [CH_3NH_3]^2 + OH^-\)
Anilin và các amin thơm khác phản ứng rất kém với nước.
- Phản ứng thế ở nhân thơm của anilin:
Thí nghiệm: Nhỏ vài giọt brom vào ống nghiệm đã đựng sẵn 1ml anilin thấy trong ống nghiệm xuất hiện kết tủa trắng.
Giải thích: Do ảnh hưởng của nhóm \(NH_2\), ba nguyên tử H ở các vị trí ortho và para so với nhóm \(NH_2\) trong nhân thơm của anilin dễ bị thay thế bởi ba nguyên tử brom.
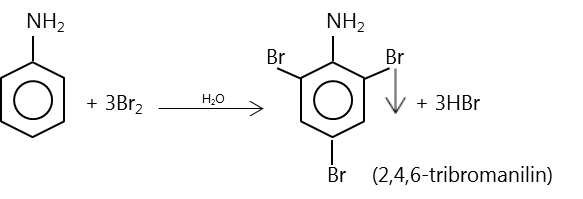
Phản ứng này để nhận biết anilin.
II. Phương pháp giải bài tập amin
1. Bài tập lý thuyết: So sánh tính bazo của amin
Tính bazo của amin phụ thuộc vào sự linh động của cặp electron tự do trên nguyên tử nito.
+ Các nhóm đẩy e (gốc ankyl) làm tăng tính bazo.
+ Các nhóm hút e (gốc không no, thơm...) làm giảm tinh ba zo.
Do đó, tính bazo tăng dần theo thứ tự: amin thơm < amin không no < \(NH_3\) < amin béo; amin béo bậc 1 < amin béo bậc 2
Riêng tính bazo của các amin béo bậc 3 còn phụ thuộc vào nhiều yếu tố khác nhau trong đó có ảnh hưởng hiệu ứng không gian của các gốc R.
2. Tính số đồng phân
Số đồng phân của amin no, đơn chức: \(2^{n-1}\) (n là số nguyên tử C).
Số đồng phân của amin no, đơn chức, bậc 1: \(2^{\frac{n-1}{2}}\).
Bậc của amin được tính bằng bậc của nguyên tố N (tính nhanh = 3 - số nguyên tử H trên N).
3. Dạng đốt cháy amin
- Công thức tổng quát amin: \(C_nH_{2n+2-2k+t}N_t\) (k: tổng số liên kết \(\pi \) và số vòng trong phân tử; k \(\geq \) 0; a: số nhóm chức amin; a \(\geq \) 1; a, k đều nguyên).
- Với a = 0, k = 1 ta có amin no, đơn chức, mạch hở: \(c_nH_{2n+3}N\).
Khi đó: \(n_amin = 2.n_{N2}\); số \(\frac{n_{CO_2}}{n_{amin}}\); số \(H = \frac{2n_{H_20}}{n_{amin}}\)
- Amin đơn chức: \(C_xH_yN\)
Phương pháp giải bài tập này: sử dụng định luật bảo toàn nguyên tố để tìm công thức amin sẽ nhanh hơn so với việc lập tỉ lệ mol \(n_C:n_H:n_N\). Đối với bài toán đốt cháy hỗn hợp các amin sẽ sử dụng công thức trung bình. Đối với bài tập đốt cháy amin bằng hỗn hợp \(O_2 \) và \(O_3\) nên quy đổi hỗn hợp thành O.
4. Dạng amin tác dụng axit
- Sử dụng công thức amin dạng: \(C_nH_{2n+1}NH_2\) hoặc \(RNH_2\).
- Từ tỉ lệ \(\frac{n_H^{+}}{n_{amin}}\) => số nhóm chức amin.
- Tăng giảm khối lượng \(n_{HCL} = \frac{m_{muối} - m_{amin}}{36,5}\)
Phương pháp giải bài tập này chủ yếu dùng định luật bảo toàn khối lượng.
5. Dạng amin tác dụng dung dịch muối
- Đặt công thức amin là \(RNH_2\).
- Chú ý tỉ lệ mol của amin và các muối cũng như kết tủa sinh ra.
6. Phản ứng muối amoni với dung dịch kiềm
Lưu ý:
- Dấu hiệu để xác định một hợp chất là muối amoni: khi hợp chất đó phản ứng với dung dịch kiềm thấy giải phóng khí hoặc giải phóng khí làm xanh giấy quỳ.
- Các loại muối amoni:
+ Muối amoni của amin hoặc \(NH_3\) với axit vô cơ như HCL,...muối amoni của amin no với \(HNO_3\) có công thức là: \(C_2H_{2n+}O_3N_2\), muối amoni của amin no và axit sunfuric có 2 dạng: muối axit \(C_nH_{2n+5}O_4NS\); muối trung hòa \(C_nH_{2n+8}O_4N_2S\); muối amoni của amin no với axit cacbonic có 2 dạng: muối axit \(C_nH_{2n+3}O_3N\) và muối trung hòa \(C_nH_{2n+6}O_3N_2\).
+ Muối amoni của amin hoặc \(NH_3\) với axit hữu cơ như HCOOH,...Muối amoni của amin no với axit no, đơn chức có công thức là: \(C_nH_{2n+3}O_2N\). Muối amoni của amin no với axit không no, đơn chức, phân tử có 1 liên kết đôi có công thức \(C_nH_{2n+1}O_2N\).
Để làm tốt, cần xác định công thức muối amoni, sau đó viết phương trình tính toán lượng chất.
Trên đây là toàn bộ lý thuyết về chủ đề amin, độc giả có thể tham khảo thêm bài tập amin tại cunghocvui.com

