Lý thuyết một số axit quan trọng chi tiết
Một số axit quan trọng là một bài lý thuyết nghiên cứu về axit phổ biến trong hóa học là axit clohiđric và axit sunfuric. Cùng Cunghocvui tìm hiểu về lý thuyết và làm các dạng bài tập bài 4 Một số axit quan trọng. Hy vọng với tài liệu bài giảng một số axit quan trọng sẽ hiệu quả với các bạn trong quá trình học về axit trong môn Hóa học 9!
A. Tóm tắt một số axit quan trọng
1. Axit clohidric.
a, Một số tính chất hóa học của axit clohiđric
Axit clohiđric là một trong axit mạnh, vì vậy nó mang đầy đủ tính chất của một axit.
- Axit clohiđric làm quỳ tím chuyển sang đỏ.
- Axit clohiđric tác dụng với nhiều kim loại để phản ứng xảy ra thu về được một muối và khí \(H_{2}\) được giải phóng ra môi trường bên ngoài.
Ví dụ: \(Al+HCl\rightarrow AlCl_{3}+H_{2}\)
- Axit clohiđric phản ứng với bazơ để thu về được một muối và nước.
Ví dụ: \(Cu(OH)_{2}+2HCl\rightarrow CuCl_{2}+2H_{2}O\) (trong đó \(CuCl_{2}\) là dung dịch có màu xanh lam)
- Axit clohiđric phản ứng với oxit bazơ để thu về muối clorua và nước.
Ví dụ: \(Cao+2HCl\rightarrow CaCl_{2}+H_{2}O\)
- Axit clohiđric phản ứng với muối trong các điều kiện sản phẩm thu về phải là một chất khí hoặc muối có hiện tượng kết tủa hoặc nước (axit yếu).
Ví dụ: \(BaCO_{3}+2HCl\rightarrow BaCl_{2}+CO_{2}+H_{2}O\)
b, Ứng dụng của axit clohidric trong thực tế cuộc sống
Axit clohidric có nhiều ứng dụng trong thực tế như:
- Làm một trong những nguyên liệu để điều chế ra muối clorua.
- Dùng trong tẩy gỉ kim loại trước khi tiến hành mạ hoặc sơn, tráng.
- Nhựa thông được dùng để làm sạch bề mặt của kim loại trước khi tiến hành hàn kim loại.
- Là nguyên liệu trong chế biến thực phẩm và dược phẩm.
2. Axit sunfuric
a, Một số tính chất vật lý của axit sunfuric
- Trong điều kiện môi trường bình thường, axit sunfuric là một chất lỏng dạng sánh, có khối lượng bằng hai lần khối lượng của nước và không có tính chất bay hơi.
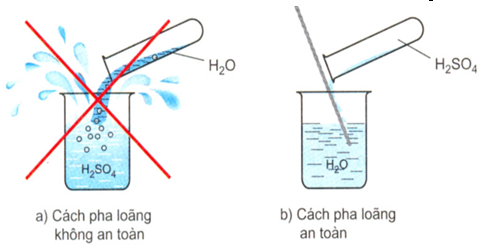
- Trong môi trường nước, axit sunfuric có tính tan và trong lúc tan thì axit sunfuric đưa ra môi trường bên ngoài rất nhiều nhiệt. Vì vậy trong quá trình làm loãng axit sunfuric bằng nước, không được cho axit sunfuric tiếp xúc với nhau một cách ồ ạt mà phải rót một các từ từ axit sunfuric đặc vào nước và liên tục khuấy đều một cách nhẹ nhàng.
b, Một số tính chất hóa học của axit sunfuric đặc
- Axit sunfuric có tính chất tác dụng với tất cả kim loại từ hai kim loại là Ag và Pt để kết quả cho ra được một muối sunfat đồng thời sản phẩm khử được giải phóng (các sản phẩm khử bao gồm \(S, SO_{2},H_{2}S\)).
Ví dụ: \(Cu+ H_{2}SO_{4}\overset{t^0}{\rightarrow} CuSO_{4}+SO_{2}+2H_{2}O\) (trong đó \(CuSO_{4}\) là một dung dịch có màu xanh lam).
- Axit sunfuric có tính háo nước.
+ Thí nghiệm chứng minh: Dùng một lượng đường để phản ứng với dung dịch \(H_{2}SO_{4}\). Sau một thời gian ta sẽ thấy xảy ra hiện tượng ban đầu đường có xu hướng chuyển sang màu nâu rồi đổi dần sang đen, có tính xốp và bị đẩy ra khỏi miệng cốc bằng bọt khí. Trong quá trình đó, một lượng rất nhiều nhiệt được tỏa ra.
+ Giải thích hiện tượng: Vì \(H_{2}SO_{4}\) mang tính háo nước nên các phân tử của đường bị hút bởi \(H_{2}SO_{4}\) tạo ra các chất rắn màu đen là Cacbon. Ta có phương trình như sau:
\(C_{12}H_{22}O_{11}\overset{H_{2}SO_{4}}{\rightarrow}12C+11H_{2}O\)
c, Ứng dụng vào thực tế và điều chế của axit sunfuric
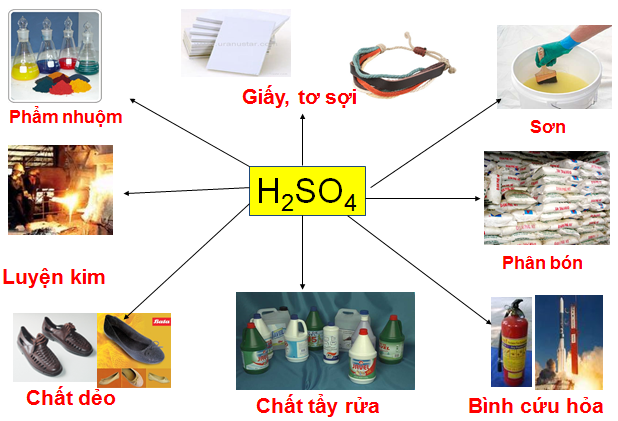
- Axit sunfuric có rất nhiều tác dụng trong cuộc sống, là nguồn nguyên liệu quan trọng trong việc sản xuất phẩm màu, chất tẩy rửa tổng hợp,...
- Để sản xuất axit sunfuric, ta phải trải qua 3 quá trình với một sơ đồ phản ứng như sau:
\(S\rightarrow SO_{2}\rightarrow SO_{3}\rightarrow H_{2}SO_{4}\)
d, Nhận biết axit sunfuric và muối sunfat
Để nhận biết axit sunfuric và dung dịch muối sunfat ta có thể dùng một số dung dịch như là \(BaCl_{2},Ba(NO_{3})_{2}, Ba(OH)_{2}\) để tạo ra một dung dịch có hiện tượng kết tủa trắng.
B. Làm bài tập hóa 9 một số axit quan trọng
1. Giải bài tập hóa 9 một số axit quan trọng. Bài tập trắc nghiệm
Câu 1: Mg, Zn và Fe là ba chất được chứa trong một hỗn hợp có khối lượng bằng 29g phản ứng hoàn toàn với dung dịch axit sunfuric loãng. Kết quả phản ứng người ta thu về được V lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Đem dung dịch thu được sau khi tác dụng đi cô cạn thì thu về được một lượng muối khan là 86,6g. Vậy lượng khí \(H_{2}\) là:
A. 6,72 lít B. 3,36 lít
C. 13,44 lít D. 8,96 lít
Câu 2 (Đề thi tuyển sinh đại học khối A năm 2008): Mg, Cu và Al là ba chất có trong một hỗn hợp X nặng 2,13g ở trạng thái dạng bột. Một hỗn hợp Y chứa các oxit nặng 3,33g là kết quả thu về được khi cho hỗn hợp X này phản ứng hết với oxi. Nếu muốn phản ứng hoàn toàn với hỗn hợp Y thì cần một dung dịch HCl 2M với một thể tích là:
A. 57ml B. 75ml
C. 50ml D. 90ml
Câu 3: Si và Sn là hai chất có trong một hỗn hợp X có khối lượng bằng 4,14g đang trong trạng thái bị hòa tan hoàn toàn bởi một dung dịch HCl dư. Kết quả có lại được một lượng 1,344 lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Cho Ni = 59, Sn = 119, trong điều kiện tiêu chuẩn, muốn tác dụng hết với 4,14g hỗn hợp X thì cần bao nhiêu lít khí \(O_{2}\)?
A. 0,784 lít B. 0,672 lít
C. 1,344 lít D. 2,24 lít
Câu 4 (Đề thi tuyển sinh đại học khối A năm 2009): Al và Sn là hai chất có trong một hỗn hợp X có khối lượng bằng 14,6g trong trạng thái bị hòa tan hoàn toàn bởi một dung dịch HCl dư. Kết quả thu lại được một lượng 5,6 lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Muốn tác dụng hết một lượng 14,6g hỗn hợp X thì cần bao nhiêu lít khí \(O_{2}\) trong điều kiện tiêu chuẩn?
A. 4,48 lít B. 1,68 lít
C. 2,80 lít D. 3,92 lít
Câu 5: Al và Zn là hai chất có trong một hỗn hợp dung dịch X có khối lượng bằng 3,68g trong trạng thái phản ứng với \(H_{2}SO_{4}\) 10% với một lượng vừa đủ. Phản ứng thu lại được một lượng 2,24 lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Sau phản ứng thu được một khối lượng dung dịch là:
A. 101,48g B. 101,68g
C. 97,80g D. 88,20g
Câu 6: Fe và một kim loại có vị trí trước \(H_{2}\) trong dãy điện hóa mang hóa trị II là hai chất có trong một hỗn hợp có khối lượng bằng 4,0g trong trạng thái được hòa tan bằng một dung dịch axit clohiđric dư. Phản ứng thu lại được một lương 2,24 lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Vậy kim loại có vị trí trước \(H_{2}\) trong dãy điện hóa mang hóa trị II là:
A. Mg B. Ca
C. Zn D. Ba
Câu 7: Mg và Al là hai chất có trong một hỗn hợp X có khối lượng là 3,87g được hòa vào một lượng 250ml dung dịch X chứa hai chất đó là HCl 1M và \(H_{2}SO_{4}\) 0,5M. Phản ứng thu về được một dung dịch B và một lượng 4,368 lít khí \(H_{2}\) trong điều kiện tiêu chuẩn. Hỏi trong hỗn hợp X ban đầu, khối lượng của Mg và Al lần lượt chiếm số phần trăm là:
A. 37,21% Mg và 62,79% Al B. 62,79% Mg và 37,41% Al
C. 45,24% Mg và 54,67% Al D. 54,67% Mg và 45,24% Al
Câu 8: Mg và Fe là hai chất có trong một hỗn hợp X trong trạng thái được hòa vào vào một lượng 200ml dung dịch bao gồm 2 chất là \(CuCl_{2}\) 0,5M và HCl 1M. Phản ứng được xảy ra hoàn toàn cho ra một hỗn hợp chứa m gam Y có hai kim loại. Hỏi trong hỗn hợp X ban đầu, khối lượng của Mg là bao nhiêu?
A. 2,4 gam B. 4,8 gam
C. 3,6 gam D. 1,2 gam
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp số | C | B | A | D | B | A | A | C |
Tham khảo thêm >>> Giải bài tập Hóa học 9 sách giáo khoa: Một số axit quan trọng
Với bài viết một số axit quan trọng, Cunghocvui đã đem lại cho các bạn bài tổng hợp lý thuyết và các dạng bài tập trắc nghiệm đầy đủ nhất về hai axit quan trọng trong Hóa học là axit clohidric và axit sunfuric. Nếu có đóng góp hay thắc mắc gì về bài 4 một số axit quan trọng, các bạn hãy để lại comment dưới phần bình luận nhé!