Bài 9 Tính chất Hóa học của muối
Bài 9 Tính chất hóa học của muối
Hôm nay, Cunghocvui sẽ giúp các bạn làm sáng tỏ nội dung của lý thuyết tính chất hóa học của muối lớp 9!
I. Các tính chất hóa học của muối
1. Muối tác dụng với chỉ thị màu
-
Khiến quỳ tím chuyển sang màu xanh
Trong kết cấu cơ bản của một muối nếu ta cho chúng phản ứng thì kết quả chỉ thị sẽ bị đổi màu nếu như trong cấu tạo đó có chứa một gốc axit hay gốc bazơ trội hơn hẳn so với gốc còn lại. Màu của quỳ có thể bị đổi thành đỏ hoặc xanh tùy ý.
VD: \(Na_2CO_3, KBr, K_2CO_3...\)
-
Khiến quỳ tím chuyển sang màu đỏ hoặc hồng
Với một số kim loại yếu khi phản ứng kết hợp tạo ra các dung dịch muối có nhóm là gốc axit thì phần axit trong muối sẽ trội hơn và có khả năng biến quỳ tím trở thành đỏ hoặc hồng
VD: \(CuSO_4,...\)
-
Trường hợp muối trung hòa không làm đổi màu của quỳ
Xảy ra khi gốc kim loại và gốc axit kết hợp có sự trung hòa về mức độ ảnh hưởng thì hoàn toàn không làm thay đổi màu của quỳ.
VD: \(KNO_3, NaCl,...\)
2. Tác dụng với hợp chất
-
Tham gia phản ứng với axit sẽ tạo ra sản phẩm là muối mới có gốc axit mạnh hơn, đồng nghĩa với việc gốc axit yếu hơn sẽ bị đẩy ra khỏi muối.
Điều kiện xảy ra phản ứng:
- Muối mới phải là muối mạnh và là chất kết tủa nên mới đủ khả năng nhận biết phản ứng.
- Axit mới ngược lại phải yếu hơn và có khả năng bốc hơi thành khí.
- Khi sản phẩm được tạo ra, muối mới luôn phải chứa một gốc trội hơn so với các gốc cũ của các chất phản ứng: CuS, HgS, Ag2S, PbS.
VD: \(BaCl_2 + H_2SO_4 \to BaSO_4 ↓ + 2HCl\)
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O [H_2CO_3] \to CO_2 + H_2O\)
-
Phản ứng tương tác giữa muối và bazơ cho ra sản phẩm là muối mới thường mạnh hơn và có tác dụng đẩy muối cũ ra khỏi các gốc ban đầu.
Điều kiện: Kết tủa sẽ dùng để nhận biết phản ứng và các chất tham gia phản ứng dễ tan trong điều kiện thường, có chất xúc tác nếu cần.
VD:\( Ca(OH)_2 + Na_2CO_3 \to CaCO_3 ↓ + 2NaOH\)
-
Trong phản ứng tương quan với kim loại, theo cơ chế kim loại yếu hơn sẽ bị kim loại mạnh hơn đẩy ra khỏi thành phần của muối.
VD: \(Mg + CuSO_4 \to MgSO_4 + Cu ↓\)
-
Trong phản ứng tương quan giữa muối với muối ta sẽ cho ra phản ứng không làm thay đổi hệ số (hay nói cách khác là phản ứng trung hòa), sản phẩm là hai muối hoàn toàn mới.
Điều kiện: Cũng cần phải có kết tủa để nhận biết phản ứng. Các muối phải là chất tan hoặc ít tan.
VD: \(BaCl_2 + Na_2SO_4 \to BaSO_4 ↓ + 2NaCl\)
3. Nhiệt phân muối
3.1. Muối cacbonat và hidrocacbonat
a) Muối hidrocacbonat
\(2R(HCO_3)n {\displaystyle { {\to[t0]}}} R_2(CO_3)n + nCO_2 ↑ + nH_2O\)
VD: \(2KHCO_3 {\displaystyle { {\to t^0]}}} K_2CO_3 +CO_2 ↑+ H_2O\)
b) Muối cacbonat
\(R_2(CO_3)_n {\displaystyle { {\to [t^0]}}} R_2O_n + nCO_2 ↑\) (R khác kim loại kiềm)
VD: \(BaCO_3 {\displaystyle { {\to [t^0]}}} BaO + CO_2 ↑\)
\(MgCO3 {\displaystyle { {\to [t^0]}}} MgO + CO_2 ↑\)
\(Na_2CO_3 {\displaystyle { {\to [t^0]}}}\) không xảy ra phản ứng hóa học.
3.2. Muối nitrat
Trường hợp 1: Muối nitrat của dạng kim loại kiềm và kiềm thổ sẽ có đặc tính như sau:
\(M(NO_3)n {\displaystyle { {\to [t^0]}}} M(NO_2)_n + n/2O_2↑\)
VD: \(2NaNO_3 {\displaystyle { {\to [t0]}}} 2NaNO_2 + O_2↑\)
Trường hợp 2: Muối nitrat của các kim loại từ Mg → Cu trong dãy hóa học
\(M(NO_3)_n {\displaystyle { {\to [t^0]}}} M_2O_n + 2nNO_2↑ + n/2O_2 ↑\)
VD: \(Al(NO_3)_3 {\displaystyle { {\to [t^0]}}} Al_2O_3 + 6NO_2 ↑ + 3/2O_2 ↑\)
Trường hợp 3: Muối nitrat của các kim loại từ Cu trở về sau trong dãy hóa học
\(M(NO_3)_n {\displaystyle { {\to [t^0]}}} M + nNO_2↑ + n/2O_2↑\)
VD: \(2AgNO_3 {\displaystyle { {\to [t^0]}}} 2Ag + 2NO_2 ↑ + O_2↑\)
\(Hg(NO_3)_2 {\displaystyle { {\to [t^0]}}} Hg + 2NO_2↑ +O_2↑\)
Chú ý:
• \(Ba(NO_3)_2\) thuộc trường hợp 2
\(Ba(NO_3)_2 {\displaystyle { {\to [t^0]}}} BaO + 2NO_2 ↑+ 1/2O_2 ↑\)
• Nhiệt phân muối \(Fe(NO_3)_2\) tạo ra \(Fe_2O_3\)
\(4Fe(NO_3)_2 {\displaystyle { {\to [t^0]}}} 2Fe_2O_3 + 8NO_2↑ + O_2↑\)
3.3. Muối sunfua
Nung muối sunfua có mặt Oxi sinh ra oxit kim loại có hóa trị cao, và đồng thời giải phóng khí lưu huỳnh đioxit
VD: \(2CuS + 3O_2 {\displaystyle { {\to [t^0]}}} 2CuO + 2SO_2↑\)
\(Al_2S_3 + 9/2O_2 {\displaystyle { {\to [t^0]}}} Al_2O_3 + 3SO_2↑\)
II. Sơ đồ tư duy tính chất hóa học của muối
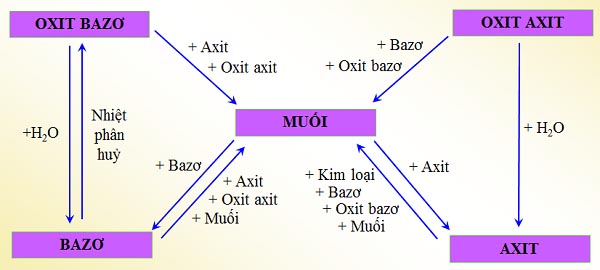
III. Làm bài tập tính chất hóa học của muối
Bài 1: Hỗn hợp X bao gồm \(Na_2CO_3 \ 1M, \ K_2CO_3 \ 0.5M\) , lấy một lượng vừa đủ khoảng 150ml hỗn hợp X trên cho tác dụng với 250 ml dung dịch HCl 2M. Trong đktc, hỗn hợp khí thu được qua phản ứng đo được là bao nhiêu?
Giải:
\(n_{CO_2^{2-}}=0.15+0.075=0.225 mol\)
\(n_{H^+}=0.25\times 2=0.5mol\)
Do trộn dung dịch X với HCl nên phản ứng có khí CO2 thoát ra ngay sau phản ứng:
\(CO_3^{-2}+2H^+\to H_2O+CO_2\)
Ta có:
\(n_H^+ pư=2n_{{CO_2}^{2-}}=2\times 0.225=0.45 <0.5\)
\(\to CO_3^{2-} \ hết \ và \ H^+ \ dư \)
\(\to n_{CO_2}=n_{CO_2^{2-}}=0.225 mol\)
Bài 2: Dung dịch X bao gồm \(Na_2CO_3 \ 1.5M, \ KHCO_3 \ 1M\). Thực hiện thí nghiệm truyền từ từ, đề tay 200ml dung dịch HCl 1M hỗn hợp X với thể tích là 100ml, kết thúc tạo được ra V ở đktc. Tính giá trị của V?
Giải:
Phản ứng xảy ra theo thứ tự:
\(CO_3^{2-}+H^+\to HCO_3^-\) (1)
\(0.15mol \to 0.15 mol \to 0.15 mol\)
\(HCO_3^-+H^+\to CO_2+H_2O\) (2)
\(0.05mol \to 0.05mol \to 0.05mol\)
Sau khi kết thúc phản ứng (2) \(HCO_3^-\) còn dư 0.2 mol nên V = 1.12 lít.
Hy vọng rằng với những kiến thức mới về tính chất hóa học của muối giải bài tập trên đây, các bạn hoàn toàn có thể nắm chắc một cách dễ dàng và có những giờ học thư giãn!

