Đề thi thử THPT Quốc Gia môn Hóa năm 2015 - Trường...
- Câu 1 : Glucozơ và fructozơ đều
A có phản ứng thủy phân.
B có nhóm –CH=O trong phân tử.
C có công thức phân tử C6H12O6.
D thuộc loại đisaccarit.
- Câu 2 : Một dung dịch X gồm 0,02 mol Na+; 0,01 mol Ca2+; 0,02 mol HCO3- và a mol ion X (bỏ qua sự điện li của nước). Ion X và giá trị của a là
A OH- và 0,02
B Cl- và 0,02
C NO3- và 0,01
D CO3(2-)và 0,01
- Câu 3 : Từ dung dịch MgCl2 ta có thể điều chế Mg bằng cách
A Cô cạn dung dịch rồi điện phân MgCl2 nóng chảy.
B Chuyển MgCl2 thành Mg(OH)2 rồi chuyển thành MgO rồi khử MgO bằng CO …
C Điện phân dung dịch MgCl2.
D Dùng Na kim loại để khử ion Mg2+ trong dung dịch.
- Câu 4 : Thủy phân hoàn toàn m1 gam este X mạch hở bằng dung dịch NaOH dư, thu được m2 gam ancol Y (không có khả năng phản ứng với Cu(OH)2) và 15 gam hỗn hợp muối của hai axit cacboxylic đơn chức Z và T (MZ < MT). Đốt cháy hoàn toàn m2 gam Y bằng oxi dư, thu được 0,3 mol CO2 và 0,4 mol H2O. Tên gọi của axit Z là
A axit metacrylic.
B axit axetic.
C axit acrylic.
D axit fomic.
- Câu 5 : Ứng dụng nào sau đây không phải của ozon ?Tẩy trắng các loại tinh bột, dầu ăn.
A Tẩy trắng các loại tinh bột, dầu ăn.
B Chữa sâu răng, bảo quản hoa quả.
C Điều chế oxi trong phòng thí nghiệm.
D Khử trùng nước uống, khử mùi.
- Câu 6 : Trong số các loại tơ sau: tơ tằm, tơ visco, tơ nilon-6,6, tơ axetat, tơ capron, tơ enang. Những loại tơ nào thuộc loại tơ nhân tạo là:
A Tơ visco và tơ nilon-6,6
B Tơ nilon – 6,6 và tơ capron.
C Tơ tằm và tơ enang.
D Tơ visco và tơ axetat.
- Câu 7 : Cho 250 gam dung dịch FeCl3 6,5% vào 150 gam dung dịch Na2CO3 10,6% thu được khí A, kết tủa B và dung dịch X. Thêm m gam dung dịch AgNO3 21,25% vào dung dịch X thu được dung dịch Y có nồng độ % cuả NaCl là 1,138%. Giá trị của m xấp xỉ bằng ?
A 176,0gam.
B 113,2 gam.
C 160 gam.
D 140 gam.
- Câu 8 : Hỗn hợp X gồm Fe3O4, CuO và Al, trong đó khối lượng oxi bằng ¼ khối lượng hỗn hợp. Cho 0,06 mol khí CO qua a gam X nung nóng, sau một thời gian thu được chất rắn Y và hỗn hợp khí Z gồm 2 khí có số mol bằng nhau. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng dư, thu được dung dịch chứa 3,08a gam muối và 0,04 mol khí NO (sản phẩm khử duy nhất). Giá trị của a xấp xỉ bằng giá trị nào sau đây? (Kết quả tính gần đúng lấy đến 2 chữ số thập phân)
A 9,02
B 9,51
C 9,48
D 9,77
- Câu 9 : Hình vẽ nào sau đây biểu diễn trạng thái cân bằng hoá học?
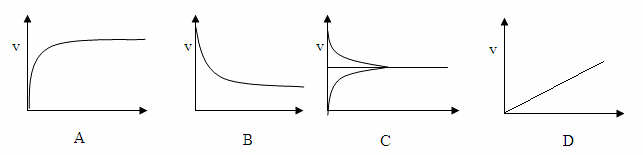
A A
B B
C C
D D
- Câu 10 : Các dung dịch nào sau đây đều có tác dụng với H2N-CH2-COOH ?
A HNO3, KNO3
B NaCl, NaOH
C HCl, NaOH
D Na2SO4, HNO3
- Câu 11 : Hoà tan hoàn toàn 2,45 gam hỗn hợp X gồm hai kim loại kiềm thổ vào 200 ml dung dịch HCl 1,25M, thu được dung dịch Y chứa các chất tan có nồng độ mol bằng nhau. Hai kim loại trong X là
A Be và Ca
B Mg và Sr
C Mg và Ca
D Be và Mg
- Câu 12 : Các nhận xét sau :
A 4
B 3
C 2
D 1
- Câu 13 : Có các kim loại Cu, Ag, Fe, Al, Au. Độ dẫn điện của chúng giảm dần theo thứ tự:
A Au, Ag, Cu, Fe, Al
B Ag, Cu, Fe, Al, Au
C Ag, Au, Cu, Al, Fe
D Ag, Cu, Au, Al, Fe
- Câu 14 : Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p64s1, nguyên tử của nguyên tố Y có cấu hình electron 1s22s22p5. Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết
A kim loại
B cộng hóa trị
C ion
D cho nhận
- Câu 15 : A, B, C là ba chất hữu cơ có %C, %H (theo khối lượng) lần lượt là 92,3% và 7,7%, tỉ lệ khối lượng mol tương ứng là 1: 2 : 3. Từ A có thể điều chế B hoặc C bằng một phản ứng. C không làm mất màu nước brom. Đốt 0,2 mol B rồi dẫn toàn bộ sản phẩm cháy qua bình đựng dung dịch nước vôi trong dư. Khối lượng bình tăng hoặc giảm bao nhiêu gam ?
A Tăng 42,4 gam.
B Giảm 37,6 gam.
C Tăng 80 gam.
D Tăng 63,6 gam.
- Câu 16 : Cho phương trình hóa học (với a, b, c, d là các hệ số):
A 2:1
B 1:2
C 1:1
D 3:1
- Câu 17 : Hỗn hợp M gồm ancol no, đơn chức X và axit cacboxylic đơn chức Y, đều mạch hở và có cùng số nguyên tử C, tổng số mol của hai chất là 0,5 mol (số mol của Y lớn hơn số mol của X). Nếu đốt cháy hoàn toàn M thì thu được 66 gam khí CO2 và 25,2 gam H2O. Mặt khác, nếu đun nóng M với H2SO4 đặc để thực hiện phản ứng este hoá (hiệu suất là 75 %) thì số gam este thu được là
A 17,10.
B 18,24.
C 25,65.
D 30,40.
- Câu 18 : Đun nóng m gam hỗn hợp gồm a mol tetrapeptit mạch hở X và 2a mol tripeptit mạch hở Y với 100 ml dung dịch NaOH 1M (vừa đủ). Sau khi các phản ứng kết thúc, cô cạn dung dịch thu được 10,26 gam muối khan của các amino axit đều có một nhóm -COOH và một nhóm -NH2 trong phân tử. Giá trị của m là
A 6,80
B 4,48
C 7,22
D 6,26
- Câu 19 : Cation M2+ có cấu hình electron phân lớp ngoài cùng là 2p6, cấu hình electron của nguyên tử M là
A 1s22s22p63s1.
B 1s22s22p4.
C 1s22s22p6.
D 1s22s22p63s2
- Câu 20 : Cho 22,25 g hỗn hợp X gồm CH2NH2CH2COOH và CH3CHNH2COOH tác dụng với V ml dung dịch NaOH 1M thu được dung dịch Y. Biết dung dịch Y tác dụng vừa đủ với 400 ml dung dịch HCl 1M. Giá trị của V là
A 100 ml
B 150 ml
C 400 ml
D 250 ml
- Câu 21 : Trùng hợp hiđrocacbon nào sau đây tạo ra polime dung để sản xuất cao su isopren?
A Penta-1,3-đien.
B But-2-en.
C 2-metylbuta-1,3-đien.
D Buta-1,3-đien.
- Câu 22 : Cao su lưu hóa có chứa 2,047% lưu huỳnh về khối lượng. Khoảng bao nhiêu mắt xích isopren có một cầu nối đisunfua -S-S-, giả thiết rằng S đã thay thế cho H ở cầu metylen trong mạch cao su?
A 57
B 46
C 45
D 58
- Câu 23 : Cho 200 ml dung dịch amino axit X nồng độ 0,2M tác dụng vừa đủ với 80 ml dung dịch NaOH 0,5M, thu được dung dịch chứa 5 gam muối. Công thức của X là
A H2NC3H5(COOH)2
B H2NC3H6COOH
C (H2N)2C4H7COOH
D H2NC2H4COOH
- Câu 24 : Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu.
A Sự oxi hóa Fe và sự oxi hóa Cu
B Sự khử Fe2+ và sự khử Cu2+.
C Sự khử Fe2+ và sự oxi hóa Cu.
D Sự oxi hóa Fe và sự khử Cu2+.
- Câu 25 : Thả Na vào dung dịch CuSO4 quan sát thấy hiện tượng
A có khí thoát ra, xuất hiện kết tủa xanh, sau đó kết tủa không tan.
B dung dịch có màu xanh, xuất hiện Cu màu đỏ.
C dung dịch mất màu xanh, xuất hiện Cu màu đỏ.
D có khí thoát ra, xuất hiện kết tủa xanh, sau đó kết tủa tan.
- Câu 26 : Đốt cháy hoàn toàn 2,76 gam hỗn hợp X gồm CxHyCOOH; CxHyCOOCH3 và CH3OH thu được 2,688 lít CO2(đktc) và 1,8 gam H2O. Mặt khác, cho 2,76 gam hỗn hợp X phản ứng vừa đủ với 30 ml dung dịch NaOH 1M, thu được 0,96 gam CH3OH. Tên gọi của CxHyCOOH là
A axit acrylic.
B axit metacrylic.
C axit axetic.
D axit propionic.
- Câu 27 : Các chất trong dãy nào sau đây đều tạo kết tủa khi cho tác dụng với dung dịch AgNO3 trong NH3 dư, đun nóng?
A vinylaxetilen, glucozơ, axit propionic.
B Glucozơ, đimetylaxetilen, anđehit axetic.
C vinylaxetilen, glucozơ, đimetylaxetilen.
D axetilen, glucozơ, anđehit axetic.
- Câu 28 : Cho cân bằng hoá học: 2SO2 (k) + O2 (k)
 2SO3 (k); phản ứng thuận là phản ứng toả nhiệt. Phát biểu đúng là
2SO3 (k); phản ứng thuận là phản ứng toả nhiệt. Phát biểu đúng là A Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
B Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
C Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
D Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
- Câu 29 : Hợp chất X là dẫn xuất của benzen có công thức phân tử C8H10O2. X tác dụng với NaOH theo tỉ lệ mol 1:1. Mặt khác cho X tác dụng với Na thì số mol H2 thu được đúng bằng số mol của X đã phản ứng. Nếu tách một phân tử H2O từ X thì tạo ra sản phẩm có thể trùng hợp tạo polime. Số công thức cấu tạo phù hợp của X là
A 7
B 9
C 6
D 3
- Câu 30 : Cho Fe tác dụng hết với dung dịch H2SO4 đặc nóng thu được khí SO2 ( sản phẩm khử duy nhất) và 8,28 gam muối. Biết số mol Fe bằng 37,5% số mol H2SO4 phản ứng. Khối lượng Fe đã tham gia phản ứng là
A 2,52 gam.
B 1,68 gam.
C 1,12 gam.
D 1,08 gam.
- Câu 31 : Cho 2,16 gam hỗn hợp gồm Al và Mg tan hết trong dung dịch axit HNO3 loãng, đun nóng nhẹ tạo ra dung dịch X và 448 ml ( đo ở 354,90 K và 988 mmHg) hỗn hợp khí Y khô gồm 2 khí không màu, không đổi màu trong không khí. Tỷ khối của Y so với oxi bằng 0,716 lần tỷ khối của khí cacbonic so với nitơ. Làm khan X một cách cẩn thận thu được m gam chất rắn Z, nung Z đến khối lượng không đổi được 3,84 gam chất rắn T. Giá trị của m là
A 15,48.
B 15,18
C 17,92.
D 16,68.
- Câu 32 : Đốt cháy hoàn toàn 6,03 gam hỗn hợp gồm axit acrylic, vinyl axetat và metyl metacrylat rồi cho toàn bộ sản phẩm cháy vào bình 1 đựng dung dịch H2SO4 đặc, bình 2 đựng dung dịch Ba(OH)2 dư thấy khối lượng bình 1 tăng m gam, bình 2 xuất hiện 53,19 gam kết tủa. Giá trị của m là
A 3,51.
B 4,86.
C 4,05.
D 3,42.
- Câu 33 : Điện phân dung dịch hỗn hợp gồm 0,2 mol FeCl3, 0,1 mol CuCl2 và 0,1 mol HCl (điện cực trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Biết hiệu suất của quá trình điện phân là 100%. Giá trị của V là
A 5,60.
B 4,48.
C 8,96.
D 11,20.
- Câu 34 : Hiđro hoá hoàn toàn m(gam) trioleoylglixerol thì thu được 89 gam tristearoylglixerol. Giá trị m là
A 88,4gam
B 87,2 gam
C 88,8 gam
D 78,8 gam
- Câu 35 : Cho sơ đồ chuyển hóa Fe(NO3)3 (+to) -> X (+CO dư) -> Y (+FeCl3) -> Z (+T) -> Fe(NO3)3Các chất X và T lần lượt là
A FeO và NaNO3
B Fe2O3 và Cu(NO3)2
C FeO và AgNO3
D Fe2O3 và AgNO3
- Câu 36 : Hình vẽ nào sau đây biểu diễn trạng thái cân bằng hoá học?
A A
B B
C C
D D
- Câu 37 : Các nhận xét sau :1. Phân đạm amoni không nên bón cho loại đất chua2. Độ dinh dưỡng của phân lân được đánh giá bằng hàm lượng %P3. Thành phần chính của supephotphat kép Ca(H2PO4)2.CaSO44. Muốn tăng cường sức chống bệnh, chống rét và chịu hạn cho cây người ta dùng loại phân bón chứa K5. Tro thực vật cũng là một loại phân kali vì có chứa: K2CO3 6. Công thức hoá học của amophot, một loại phân bón phức hợp là:(NH4)2HPO4 và NH4H2PO4Số nhận xét không đúng là:
A 4
B 3
C 2
D 1
- Câu 38 : Cho các phản ứng sau :(1) SO2 + H2O -> H2SO3 (2) SO2 + CaO -> CaSO3(3) SO2 + Br2 + 2H2O -> H2SO4 + 2HBr (4) SO2 + 2H2S -> 3S + 2H2OTrên cơ sở các phản ứng trên, kết luận nào sau đây là đúng với tính chất cơ bản của SO2 ?
A Phản ứng (4) chứng tỏ tính khử của SO2 > H2S.
B Trong phản ứng (3), SO2 đóng vai trò chất khử.
C Trong các phản ứng (1,2) SO2 là chất oxi hoá.
D Trong phản ứng (1), SO2 đóng vai trò chất khử.
- Câu 39 : Cho phương trình hóa học (với a, b, c, d là các hệ số): aFe2O3 + b Al -> cAl2O3 + dFe Tỉ lệ a : c là
A 2:1
B 1:2
C 1:1
D 3:1
- Câu 40 : Cho phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu.Trong phản ứng trên xảy ra
A Sự oxi hóa Fe và sự oxi hóa Cu
B Sự khử Fe2+ và sự khử Cu2+.
C Sự khử Fe2+ và sự oxi hóa Cu.
D Sự oxi hóa Fe và sự khử Cu2+.
- Câu 41 : Cho cân bằng hoá học: 2SO2 (k) + O2 (k)
2SO3 (k); phản ứng thuận là phản ứng toả nhiệt. Phát biểu đúng là
A Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất hệ phản ứng.
B Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ SO3.
C Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ
D Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ O2.
- - Bộ câu hỏi Nhanh như chớp !!
- - Trắc nghiệm lý thuyết bằng lái xe máy A1 - Đề số 1 (Có đáp án)
- - Trắc nghiệm môn luật đất đai - Đề số 1 (Có đáp án)
- - Trắc nghiệm môn luật đất đai - Đề số 2 (Có đáp án)
- - Trắc nghiệm ngữ pháp Tiếng Anh tìm lỗi sai - Đề số 1 (Có đáp án)
- - Trắc nghiệm môn luật đất đai - Đề số 3 (Có đáp án)
- - Trắc nghiệm môn luật đất đai - Đề số 4 (Có đáp án)
- - Trắc nghiệm lý thuyết bằng lái xe máy A1 - Đề số 2
- - Trắc nghiệm lý thuyết bằng lái xe máy A1 - Đề số 3
- - Trắc nghiệm lý thuyết bằng lái xe máy A1 - Đề số 4

