Đề thi thử THPT Quốc Gia - ĐH môn hóa năm 2015, Đề...
- Câu 1 : Câu 1. Đề 19
A 2
B 4
C 6
D 1
- Câu 2 : Cho phản ứng sau: C6H5NO2 + Fe + HCl
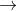 C6H5NH3Cl + FeCl2 + H2O. Với hệ số các chất trong phương trình là các số nguyên đơn giản nhất. Vậy tổng đại số các hệ số của chúng là:
C6H5NH3Cl + FeCl2 + H2O. Với hệ số các chất trong phương trình là các số nguyên đơn giản nhất. Vậy tổng đại số các hệ số của chúng là: A 23
B 21
C 19
D 17
- Câu 3 : Người ta tiến hành trộn các khí sau đây với nhau: H2 và F2 (1); Cl2 và O2 (2); H2S và N2 (3); CO và O2 (4); NH3 và Cl2 (5); H2S và SO2 (6); HI và O3 (7).
A (1); (5); (6); (7)
B (1); (5); (6)
C (1); (2); (5); (6)
D (1); (3); (6); (7)
- Câu 4 : Khối lượng oleum có công thức H2SO4.3SO3 cần cho vào 500 gam dung dịch H2SO4 70% để thu được dung dịch H2SO4 98% là
A 568,2 gam
B 642,3 gam
C 777,8 gam
D 892,9 gam
- Câu 5 : Dẫn luồng khí CO đến dư qua ống sứ chứa 26,72 gam chất oxit X đun nóng, khí thoát ra khỏi ống được hấp thụ hết bởi dung dịch Ba(OH)2 thu được 39,4 gam kết tủa, lọc bỏ kết tủa, đun nóng dung dịch nước lọc thu thêm 19,7 gam kết tủa nữa. Rắn còn lại trong ống cho tác dụng với HNO3 đặc, nóng dư thu được 17,92 lít NO2 (đktc). Biết hiệu suất các phản ứng đều đạt 100%. Số mol HNO3 tham gia phản ứng là.
A 1,2 mol
B 1,4 mol
C 0,8 mol
D 1,0 mol
- Câu 6 : Chất nào sau đây có liên kết hiđro giữa các phân tử ?
A H2O, HF
B H2S , HCl
C SiH4, CH4
D PH3, NH3
- Câu 7 : Tính chất vật lí nào sau đây của kim loại không do các electron tự do quyết định?
A Tính dẫn điện
B Khối lượng riêng
C Ánh kim
D Tính dẫn nhiệt.
- Câu 8 : Điện phân dd chứa m gam hỗn hợp NaCl và Cu(NO3)2 đến khi dd hết màu xanh thì ở anot thu được 3,36 lít (đktc) hỗn hợp khí A, Biết tỉ khối của A so với H2 là 29. Giá trị m là
A 53 gam
B 49,3 gam
C 32,5 gam
D 30,5 gam
- Câu 9 : Cho dãy các chất: SiO2; Cr(OH)3; CrO; CrO3; Zn(OH)2; NaHCO3 và Al2O3. Số chất trong dãy tác dụng được với dung dịch NaOH đặc nóng là:
A 6
B 3
C 5
D 4
- Câu 10 : Trong các phát biểu sau :
A 3
B 4
C 5
D 2
- Câu 11 : Hấp thụ hoàn toàn 0,336 lít khí CO2 (ở đktc) vào 100 ml dung dịch hỗn hợp gồm NaOH 0, 15M và Ba(OH)2 0,05M, sinh ra m gam kết tủa. Giá trị của m là
A 1,970.
B 0,985.
C 2,955.
D 1,182.
- Câu 12 : Để Cr(OH)2 ngoài không khí sau một thời gian thấy hiện tượng:
A chuyển từ màu vàng sang màu tím
B chuyển từ màu vàng sang màu nâu đỏ
C không bị chuyển màu
D chuyển từ màu vàng sang màu xanh nhạt
- Câu 13 : Khi thêm dung dịch Na2CO3 vào dung dịch FeCl3 sẽ có hiện tượng gì xảy ra?
A Xuất hiện kết tủa màu nâu đỏ vì xảy ra hiện tượng thủy phân
B Dung dịch vẫn có màu nâu đỏ vì chúng không pứ với nhau
C Xuất hiện kết tủa màu nâu đỏ đồng thời có hiện tượng sủi bọt khí
D Có kết tủa nâu đỏ tạo thành sau đó tan lại do tạo khí CO2
- Câu 14 : Cho m (gam) kim loại Fe vào 1 lít dung dịch chứa AgNO3 0,1M và Cu(NO3)2 0,1M. Sau phản ứng người ta thu được 15,28g rắn và dung dịch X. Giá trị của m là
A 6,72.
B 2,80.
C 8,40.
D 17,20.
- Câu 15 : Cho các phát biểu dưới đây:
A (2), (3), (4).
B (2).
C (2), (4)
D (1), (2), (4)
- Câu 16 : Cho 0,2 mol Fe vào dung dịch hỗn hợp chứa 0,2 mol Fe(NO3)3 và 0,2 mol AgNO3. Khi phản ứng hoàn toàn, số mol Fe(NO3)3 trong dung dịch bằng :
A 0,3.
B 0,2.
C 0,4.
D 0,0.
- Câu 17 : Phát biểu nào sau đây là sai?
A Na2CO3 là nguyên liệu quan trọng trong công nghiệp sản xuất thủy tinh.
B Các kim loại kiềm đều có cấu trúc mạng tinh thể lập phương tâm khối.
C Thạch cao sống (CaSO4.2H2O) được dùng để bó bột, đúc tượng.
D Thành phần chính của quặng đolomit là CaCO3.MgCO3.
- Câu 18 : Phát biểu nào sau đây là đúng ?
A Trong công nghiệp nhôm được sản xuất từ quặng đolomit.
B CrO3 tác dụng với nước tạo ra hỗn hợp axit.
C Tất cả các phản ứng của lưu huỳnh với kim loại đều cần đun nóng.
D Ca(OH)2 được dùng làm mất tính cứng vĩnh cửu của nước.
- Câu 19 : Hòa tan hết 19,6 gam hỗn hợp X gồm Fe3O4 và CuO bằng một lượng vừa đủ dung dịch HCl 1M, thu được dung dịch Y. Cho Y tác dụng với lượng dư dung dịch H2S, kết thúc các phản ứng thu được 11,2 gam kết tủa. Thể tích dung dịch HCl 1M đã dùng là
A 300 ml
B 600 ml
C 400 ml
D 615 ml
- Câu 20 : Hấp thụ 6,72 lít SO2 (đktc) vào 200 ml dung dịch KOH 1M, NaOH 0, 85M, BaCl2 0, 45M sau đó cho tiếp 300ml dung dịch Ba(OH)2 0,1M thu được m gam kết tủa. Giá trị m là
A 26,04
B 19,53
C 28,21
D 13,02
- Câu 21 : Chọn một hóa chất nào sau đây thường dùng (rẻ tiền) để loại bỏ các chất HF, NO2, SO2 trong khí thải công nghiệp và cation Pb2+, Cu2+ trong nước thải các nhà máy ?
A NH3
B NaOH
C Ca(OH)2
D NaCl
- Câu 22 : Hợp chất C5H10 có bao nhiêu đồng phân anken?
A 4
B 5
C 6
D 7
- Câu 23 : Số đồng phân cấu tạo của C4H11N và C3H7Cl lần luợt là :
A 8 và 3
B 7 và 2
C 8 và 2
D 7 và 3
- Câu 24 : Hiđrocacbon X có công thức phân tử C6H10. X tác dụng với dung dịch AgNO3 trong dung dịch NH3 tạo kết tủa vàng. Khi hiđro hoá hoàn toàn X thu được
A 3,3-đimetylbut-1-in.
B 3,3-đimetylpent-1-in.
C 2,2-đimetylbut-3-in.
D 2,2-đimetylbut-2-in.
- Câu 25 : Đun nóng cho phản ứng hoàn toàn 23 gam C2H5OH có mặt H2SO4 đặc với nhiệt độ thích hợp được hỗn hợp X gồm ete, ôlefin, H2O. Toàn bộ X phản ứng với Na dư được 0,2 mol H2. Tính tỷ lệ % khối lượng ete trong hỗn hợp
A 45%
B 25,74%
C 32,17%
D 38,6%
- Câu 26 : Cho dãy gồm các chất: Na, O2, Cu(OH)2, Cu, C2H5OH, C6H5NH2. Số chất tác dụng được với axit axetic (trong điều kiện thích hợp) là:
A 6
B 3
C 4
D 5
- Câu 27 : Cho 0,01 mol một este X của axit hữu cơ phản ứng vừa đủ với 100 ml dung dịch NaOH 0,2 M, sản phẩm tạo thành chỉ gồm một ancol Y và một muối Z với số mol bằng nhau. Mặt khác, khi xà phòng hoá hoàn toàn 1,29 gam este đó bằng một lượng vừa đủ là 60 ml dung dịch KOH 0,25 M, sau khi phản ứng kết thúc đem cô cạn dung dịch được 1,665 gam muối khan. Công thức của este X là:
A C2H4(COO)2C4H8
B C4H8(COO)2C2H4
C C2H4(COOC4H9)2
D C4H8(COO C2H5)2
- Câu 28 : Trong số các chất: Glucozơ, Fructozơ, Saccarozơ, Mantozơ. Số lượng các chất được gọi là đường khử là :
A 1
B 2
C 3
D 4
- Câu 29 : Phương trình hóa học nào sau đây không đúng?
A C6H5NO2 + 3Fe +7HCl
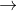 C6H5NH3Cl + 3FeCl2 + 2H2O
C6H5NH3Cl + 3FeCl2 + 2H2OB FeCl3 + 3CH3NH2 + 3H2O
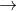 Fe(OH)3 + 3CH3NH3Cl
Fe(OH)3 + 3CH3NH3ClC C6H5NH2 + 2Br2
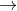 3,5-Br2-C6H3NH2 + 2HBr
3,5-Br2-C6H3NH2 + 2HBrD 2CH3NH2 + H2SO4
 (CH3NH3)2SO4
(CH3NH3)2SO4 - Câu 30 : Hỗn hợp A gồm hai aminoaxit chứa một nhóm amino, một nhóm chức axit (nhóm cacboxyl), no, mạch hở, đồng đẳng kế tiếp. Cho m gam hỗn hợp A tác dụng hoàn toàn với 200 ml dung dịch HCl 2M (có dư), được dung dịch B. Để phản ứng hết với các chất trong dung dịch B thì phải cần dùng 250 ml dung dịch NaOH 2,8 M. Mặt khác, nếu đốt cháy hết m gam hỗn hợp A rồi cho hấp thụ sản phẩm cháy vào bình đựng lượng dư dung dịch xút, khối lượng bình tăng 52,3 gam. Cho biết N trong aminoaxit khi cháy tạo N2. Công thức hai chất trong hỗn hợp A là:
A H2NC3H6COOH; H2NC4H8COOH
B H2NC4H8COOH; H2NC5H10COOH
C H2NCH2COOH; H2NC2H4COOH
D H2NC2H4COOH; H2NC3H6COOH
- Câu 31 : Đốt cháy hoàn toàn 1 mol hợp chất hữu cơ X, thu được 4 mol CO2. Chất X tác dụng được với Na, tham gia phản ứng tráng bạc và phản ứng cộng dung dịch Br2 theo tỉ lệ mol 1 : 1. Công thức cấu tạo của X là
A HO-CH2-CH2-CH=CH-CHO.
B HOOC-CH=CH-COOH.
C HO-CH2-CH=CH-CHO.
D HO-CH2-CH2-CH2-CHO.
- Câu 32 : Hợp chất hữu cơ X có khối lượng phân tử 60 đvC, chỉ chứa các nguyên tố C,H,O. Số CTCT mạch hở có thể có của X là?
A 4
B 5
C 6
D 7
- Câu 33 : Thủy phân các chất sau trong môi trường kiềm : CH3 - CHCl2 (1), CH3 - COO - CH = CH - CH2 (2), CH3 - COOC(CH3) = CH2 (3), CH3 - CH2 - CCI3 (4), CH3 - COO - CH2 - OOC - CH3 (5), HCOO - C2H5 (б). Nhóm các chất sau khi thủy phân cho sản phẩm có khả năng tham gia phản ứng tráng gương là:
A (1),(4),(5),(6)
B (1),(2),(3),(6).
C (1),(2),(3),(5).
D (1),(2),(5),(6).
- Câu 34 : Câu 50. dề 19
A 50,00% và 66,67%.
B 33,33% và 50,00%.
C 66,67% và 33,33%.
D
66,67% và 50,00%.
- Câu 35 : Câu 1. Đề 19 Nguyên tố Cu có nguyên tử khối trung bình là 63,54 có 2 đồng vị X và Y, biết tổng số khối là 128. Số nguyên tử đồng vị X = 0,37 số nguyên tử đồng vị Y. Vậy số nơtron của đồng vị Y ít hơn số nơtron của đồng vị X là:
A 2
B 4
C 6
D 1
- Câu 36 : Cho phản ứng sau: C6H5NO2 + Fe + HCl
C6H5NH3Cl + FeCl2 + H2O. Với hệ số các chất trong phương trình là các số nguyên đơn giản nhất. Vậy tổng đại số các hệ số của chúng là:
A 23
B 21
C 19
D 17
- Câu 37 : Trong thí nghiệm như hình vẽ hai ống nghiệm như nhau đều chứa lượng khí NO2 như nhau và được nút kín ở chỗ nối hai nhánh, một ống được đun nóng, ống kia được cho vào chậu nước đá. Kết luận nào dưới đây đúng:
A Ống nghiệm bên trái có màu nhạt hơn ống nghiệm bên phải.
B Ống nghiệm bên trái có áp suất lớn hơn
C Ống nghiệm bên phải chỉ chứa khí N2O4
D Ống nghiệm bên trái chứa lượng khí nặng hơn ống nghiệm bên phải.
- Câu 38 : Người ta tiến hành trộn các khí sau đây với nhau: H2 và F2 (1); Cl2 và O2 (2); H2S và N2 (3); CO và O2 (4); NH3 và Cl2 (5); H2S và SO2 (6); HI và O3 (7).Những hỗn hợp khí không tồn tại ở nhiệt độ thường là:
A (1); (5); (6); (7)
B (1); (5); (6)
C (1); (2); (5); (6)
D (1); (3); (6); (7)
- Câu 39 : Trong các phát biểu sau :(1) Theo chiều tăng dần điện tích hạt nhân, các kim loại kiềm thổ (từ Be đến Ba) có nhiệt độ nóng chảy giảm dần.(2) Kim loại Mg có kiểu mạng tinh thể lập phương tâm diện.(3) Các kim loại Na, Ba, Be đều tác dụng với nước ở nhiệt độ thường.(4) Kim loại Mg tác dụng với hơi nước ở nhiệt độ cao.(5) Trong công nghiệp, kim loại Al được điều chế bằng phương pháp điện phân Al2O3 nóng chảy.(6) Kim loại Al tan được trong dung dịch HNO3 đặc, nguội. Số phát biểu đúng là
A 3
B 4
C 5
D 2
- Câu 40 : Cho các phát biểu dưới đây:(1) Các halogen (F, Cl, Br, I) có số oxi hóa từ −1 đến +7.(2) Flo là chất chỉ có tính oxi hóa.(3) F2 đẩy được Cl2 ra khỏi dung dịch muối NaCl.(4) Tính axit của các hợp chất với hiđro của các halogen tăng theo thứ tự: HF < HCl < HBr < HI.Các phát biểu luôn đúng là
A (2), (3), (4).
B (2).
C (2), (4)
D (1), (2), (4)
- Câu 41 : X là hỗn hợp gồm Fe và 2 oxit của sắt. Hòa tan hết 15,12 gam X trong dung dịch HCl dư , sau phản ứng thu được 16,51 gam muối Fe (II) và m gam muối Fe (III ) . Mặt khác , khi cho 15,12 gam X phản ứng hoàn toàn với dung dịch acid nitric loãng dư thì giải phóng 1,568 lít NO ( sản phẩm khử duy nhất - ở đktc ). Thành phần % về khối lượng của Fe trong X là ?
A 11,11%
B 29,63%
C 14,81%
D 33,33%
- Câu 42 : Cho các phản ứng sau:a . C2H6 + Br2 d . 2C2H5OH -> C2H5OC2H5+ H2Ob . C2H2 + Br2 e . C2H5COOH + Na c . C2H5OH + HBr f . CH3CHO + H2 Các phản ứng thuộc loại thuộc loại phản ứng thế là:
A a, d, e
B a, f, e
C a, e, c ,f
D a, c, d, e
- Câu 43 : Hiđrocacbon X có công thức phân tử C6H10. X tác dụng với dung dịch AgNO3 trong dung dịch NH3 tạo kết tủa vàng. Khi hiđro hoá hoàn toàn X thu được2,2-đimetylbutan . X là
A 3,3-đimetylbut-1-in.
B 3,3-đimetylpent-1-in.
C 2,2-đimetylbut-3-in.
D 2,2-đimetylbut-2-in.
- Câu 44 : Cho các phát biểu sau:(1) Polime được điều chế bằng phản ứng trùng hợp hay trùng ngưng.(2) Các polime đều không tác dụng với axit hay bazơ.(3) Protein là một loại polime thiên nhiên. (4) Cao su buna-S có chứa lưu huỳnh.Số phát biểu đúng là:
A 1
B 4
C 2
D 3
- Câu 45 : Cho các phát biểu sau:(a) Có thể dùng nước brom để phân biệt glucozơ và fructozơ. (b) Trong môi trường axit, glucozơ và fructozơ có thể chuyển hóa lẫn nhau. (c) Có thể phân biệt glucozơ và fructozơ bằng phản ứng với dung dịch AgNO3 trong NH3. (d) Trong dung dịch, glucozơ và fructozơ đều hòa tan Cu(OH)2 ở nhiệt độ thường cho dung dịch màu xanh lam.(e) Trong dung dịch, fructozơ tồn tại chủ yếu ở dạng mạch hở.(f) Trong dung dịch, glucozơ tồn tại chủ yếu ở dạng mạch vòng 6 cạnh (dạng α và β). Số phát biểu đúng là
A 5
B 3
C 2
D 4
- Câu 46 : Đốt cháy hoàn toàn 23,8 gam hỗn hợp X gồm axit acrylic, axit adipic, axit propanoic và glixerol (trong đó số mol axit acrylic bằng số mol axit propanoic) bằng O2 dư thu được hỗn hợp Y gồm khí và hơi. Dẫn Y vào dung dịch chứa 0,7 mol Ba(OH)2 thu được 98,5 gam kết tủa và dung dịch Z. Đun nóng Z lại thấy xuất hiện kết tủa. Cho 23,8 gam hỗn hợp n X tác dụng với 300ml dung dịch KOH 1M, sau khi các phản ứng xảy ra hoàn toàn, cô cạn dung dịch thu được chất rắn khan có khối lượng là:
A 15,8 gam
B 22,2 gam
C 16,6 gam
D 27,8 gam
- Câu 47 : Hỗn hợp X gồm 2 chất hữu cơ đơn chức, đều có chứa C, H, O, đều có %O = 53,33%.-m gam hỗn hợp X tác dụng với dung dịch AgNO3/NH3 dư, t0 thu được tối đa 12,96 gam Ag.-m gam hỗn hợp X tác dụng vừa đủ với 336ml H2 ở đktc (Ni, t0).Tỉ lệ khối lượng của hai chất hữu cơ trong m gam hỗn hợp X là
A 1:1.
B 1:2.
C 1:3.
D 1: 4.
- Câu 48 : Câu 50. dề 19 Cho m gam hỗn hợp X gồm hai ancol đơn chức X1, X2 đồng đẳng kế tiếp (MX1 < MX2), phản ứng với CuO nung nóng, thu được 0,25 mol H2O và hỗn hợp Y gồm hai anđehit tương ứng và hai ancol dư. Đốt cháy hoàn toàn Y thu được 0,5 mol CO2 và 0,65 mol H2O. Mặt khác, cho toàn bộ lượng Y trên tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng, kết thúc các phản ứng thu được 0,9 mol Ag. Hiệu suất tạo anđehit của X1, X2 lần lượt là
A 50,00% và 66,67%.
B 33,33% và 50,00%.
C 66,67% và 33,33%.
D
66,67% và 50,00%.
- - Trắc nghiệm Hóa học 12 Bài 2 Lipit
- - Trắc nghiệm Hóa học 12 Bài 3 Khái niệm về Xà phòng và Chất giặt rửa tổng hợp
- - Trắc nghiệm Hóa học 12 Bài 4 Luyện tập Este và Chất béo
- - Trắc nghiệm Hóa học 12 Bài 5 Glucozơ
- - Trắc nghiệm Hóa học 12 Bài 6 Saccarozơ, Tinh bột và Xenlulozơ
- - Trắc nghiệm Hóa học 12 Bài 7 Luyện tập Cấu tạo và tính chất của Cacbohidrat
- - Trắc nghiệm Hóa học 12 Bài 9 Amin
- - Trắc nghiệm Hóa học 12 Bài 10 Amino axit
- - Trắc nghiệm Hóa học 12 Bài 11 Peptit và Protein
- - Hóa học 12 Bài 12 Luyện tập Cấu tạo và tính chất của Amin, Amino axit và Protein

