80 câu trắc nghiệm Đại cương về kim loại cơ bản !!
- Câu 1 : Công thức chung của oxit kim loại thuộc nhóm IIA là
A. R2O3
B. RO2
C. R2O
D. RO
- Câu 2 : Nguyên tử Fe có cấu hình e là
A. [Ar ] 3d6 4s2
B. [Ar ] 4s13d7
C. [Ar ]3d7 4s1
D. [Ar ] 4s23d6
- Câu 3 : Cấu hình e của Cr là
A. [Ar ] 3d4 4s2
B. [Ar ] 4s23d4
C. [Ar ] 3d5 4s1
D. [Ar ] 4s13d5
- Câu 4 : Kim loại Ni phản ứng được với tất cả các muối trong dung dịch ở dãy nào sau đây ?
A. NaCl, AlCl3, ZnCl2
B. MgSO4, CuSO4, AgNO3
C. Pb(NO3)2 , AgNO3, NaCl
D. AgNO3, CuSO4, Pb(NO3)2
- Câu 5 : Cho ba kim loại là Al, Fe, Cu và bốn dung dịch muối riêng biệt là ZnSO4, AgNO3, CuCl2, MgSO4. Kim loại nào tác dụng được với cả bốn dung dịch muối đã cho ?
A. Al
B. Fe
C. Cu
D. Không kim loại
- Câu 6 : Cho khí CO dư đi qua hỗn hợp gồm CuO, Al2O3 và MgO (nung nóng). Khi phản ứng xảy ra hoàn toàn thu được chất rắn gồm :
A. Cu, Al, Mg
B. Cu, Al, MgO
C. Cu, Al2O3, Mg
D. Cu, Al2O3, MgO
- Câu 7 : Nguyên tử kim loại khi tham gia phản ứng hoá học có tính chất nào sau đây ?
A. Nhường electron và tạo thành ion âm
B. Nhường electron và tạo thành ion dương
C. Nhận electron để trở thành ion âm
D. Nhận electron để trở thành ion dương
- Câu 8 : Cặp chất không xảy ra phản ứng là
A. Fe + Cu(NO3)2
B. Cu + AgNO3
C. Zn + Fe(NO3)2
D. Ag + Cu(NO3)2
- Câu 9 : Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường tạo ra dung dịch có môi trường bazơ là:
A. Na, Ba, K
B. Be, Na, Ca
C. Na, Fe, K
D. Na, Cr, K
- Câu 10 : Để loại bỏ kim loại Cu ra khỏi hỗn hợp bột gồm Ag và Cu, người ta ngâm hỗn hợp kim loại trên vào lượng dư dung dịch
A. AgNO3
B. HNO3
C. Cu(NO3)2
D. Fe(NO3)2
- Câu 11 : Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi
A. cấu tạo mạng tinh thể của kim loại
B. khối lượng riêng của kim loại
C. các electron độc thân trong tinh thể kim loại
D. các electron tự do trong tinh thể kim loại
- Câu 12 : So với nguyên tử phi kim cùng chu kì, nguyên tử kim loại
A. thường có bán kính nguyên tử nhỏ hơn
B. thường có năng lượng ion hoá nhỏ hơn
C. thường dễ nhận electron trong các phản ứng hoá học
D. thường có số electron ở các phân lớp ngoài cùng nhiều hơn
- Câu 13 : Kim loại nào sau đây có tính dẫn điện tốt nhất trong tất cả các kim loại ?
A. Vàng
B. Bạc
C. Đồng
D. Nhôm
- Câu 14 : Kim loại nào sau đây dẻo nhất trong tất cả các kim loại ?
A. Vàng
B. Bạc
C. Đồng
D. Nhôm
- Câu 15 : Kim loại nào sau đây có độ cứng lớn nhất trong tất cả các kim loại ?
A. Vonfam
B. Crom
C. Sắt
D. Đồng
- Câu 16 : Kim loại nào sau đây là kim loại mềm nhất trong tất cả các kim loại ?
A. Liti
B. Xesi
C. Natri
D. Kali
- Câu 17 : Kim loại có nhiệt độ nóng chảy cao nhất trong tất cả các kim loại ?
A. Vonfam
B. Đồng
C. Sắt
D. Kẽm
- Câu 18 : Kim loại nào sau đây nhẹ nhất (có khối lượng riêng nhỏ nhất) trong tất cả các kim loại
A. Liti
B. Rubidi
C. Natri
D. Kali
- Câu 19 : Bao nhiêu gam clo tác dụng vừa đủ kim loại nhôm tạo ra 26,7 gam AlCl3?
A. 21,3 gam
B. 12,3 gam
C. 13,2 gam
D. 23,1 gam
- Câu 20 : Một thanh kim loại M hóa trị 2 được nhúng vào trong 1 lít dung dịch CuSO4 0,5M. Sau khi lấy thanh M ra và cân lại ,thấy khối lượng thanh tăng 1,6 gam, nồng độ CuSO4 còn 0,3M. Hãy xác định kim loại M?
A. Fe
B. Mg
C. Zn
D. Pb
- Câu 21 : Ngâm một lá kẽm trong 100ml dung dịch AgNO3 0,1 mol. Kết thúc phản ứng, khối lượng lá kẽm tăng a gam. Giá trị a là?
A. 0,655g
B. 0,75g
C. 0,65g
D. 0,755g
- Câu 22 : Cho 8,4 g Fe vào dung dịch có chứa 0,4mol AgNO3. Kết thúc phản ứng, khối lượng bạc là bao nhiêu?
A. 42,3g
B. 23,4g
C. 43,2g
D. 21,6g
- Câu 23 : Cho biết các cặp oxi hoá- khử sau :
A. Cu2+, Fe2+, Fe3+
B. Cu2+, Fe3+,Fe2+
C. Fe3+,Cu2+, Fe2+
D. Fe2+ ,Cu2+, Fe3+
- Câu 24 : Muốn khử dd chứa Fe3+ thành dd có chứa Fe2+ cần dùng kim loại sau:
A. Cu
B. Na
C. Zn
D. Ag
- Câu 25 : Cho các kim loại: Fe , Al , Mg , Cu , Zn , Ag. Số kim loại tác dụng được với dd H2SO4 loãng là:
A. 5
B. 3
C. 6
D. 4
- Câu 26 : Ngâm Cu dư vào dd AgNO3 thu được dd X, sau đó ngâm Fe dư vào dung dịch X thu được dung dịch Y. dung dịch Y gồm:
A. Fe(NO3)2
B. Fe(NO3)2 , Cu(NO3)2 , AgNO3
C. Fe(NO3)2 , Cu(NO3)2
D. Fe(NO3)3
- Câu 27 : Ngâm đinh sắt sạch trong 200 ml dd CuSO4. Sau phản ứng kết thúc lấy đinh sắt ra rửa nhẹ và làm khô thấy khối lượng đinh sắt tăng 8 gam. Nồng độ CuSO4 ban đầu là:
A. 0,52 M
B. 0,5 M
C. 5 M
D. 0,25 M
- Câu 28 : Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau khi điện phân cho ra một dung dịch axit (điện cực trơ).
A. CuSO4
B. K2SO4
C. NaCl
D. KNO3
- Câu 29 : Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại điều chế được bằng phương pháp điện phân dung dịch (điện cực trơ) là:
A. 3
B. 1
C. 2
D. 4
- Câu 30 : Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy?
A. Fe
B. Cu
C. Mg
D. Ag
- Câu 31 : Trong quá trình điện phân, các muối X- (X: Cl-, Br-) di chuyển về:
A. Cực dương và bị oxi hóa
B. Cực âm và bị oxi hóa
C. Cực dương và bị khử
D. Cực âm và bị khử
- Câu 32 : Cho dung dịch chứa các ion: Na+, K+, Cu+, Cl-, SO42-, NO3-. Các ion nào không bị điện phân khi ở trạng thái dung dịch:
A. Na+, K+, Cl-, SO42-
B. K+, Cu+, Cl-, NO3-
C. Na+, Cu+, Cl-, SO42-
D. Na+, K+, SO42-, NO3-
- Câu 33 : Điện phân một lượng dư dung dịch MgCl2 (điện cực trơ, có màng ngăn xốp bao điện cực) với cường độ dòng điện 2,68A trong 2 giờ. Sau khi dừng điện phân khối lượng dung dịch giảm m gam, giả thiết nước không bay hơi, các chất tách ra đều khan. Giá trị của m là:
A. 8,7
B. 18,9
C. 7,3
D. 13,1.
- Câu 34 : Điện phân nóng chảy hoàn toàn 1,9g muối clorua của kim loại M được 0,48g kim loại M ở catot. Kim loại M là:
A. Zn
B. Ca
C. Mg
D. Ba
- Câu 35 : Điện phân một dd muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
A. Mg
B. Fe
C. Cu
D. Ca
- Câu 36 : Nếu muốn điện phân hoàn toàn (mất màu xanh) 400 ml dung dịch CuSO4 0,5M với cường độ dòng điện I = 1,34A (hiệu suất điện phân là 100%) thì cần bao nhiêu thời gian.
A. 6 giờ
B. 7 giờ
C. 8 giờ
D. 9 giờ
- Câu 37 : Điện phân dung dịch muối CuSO4 dư trong thời gian 1930 giây, thu được 1,92 gam Cu ở catot. Cường độ dòng điện trong quá trình điện phân là giá trị nào dưới đây:
A. 3A
B. 4,5A
C. 1,5A
D. 6A
- Câu 38 : Điện phân hòa toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở đktc) ở anot. Kim loại trong muối là:
A. Na
B. Ca
C. K
D. Mg
- Câu 39 : Điện phân 250g dd CuSO4 8% đến khi nồng độ CuSO4 trong dd thu được giảm đi và bằng một nửa so với trước phản ứng thì dừng lại. Khối lượng kim bám ở catot gần với giá trị nào?
A. 4,08g
B. 2,04g
C. 4,58g
D. 4,5g
- Câu 40 : Điện phân dung dịch CuCl2, điện cực trơ bằng dòng điện 5A trong 45 phút 20 giây. Tính khối lượng kim loại sinh ra ở Catot .
A. 4,512g
B. 4,5g
C. 4,6g
D. 4,679g
- Câu 41 : Biết rằng ion Pb2+ trong dung dịch oxi hóa được Sn. Khi nhúng hai thanh kim loại Pb và Sn được nối với nhau bằng dây dẫn điện vào một dung dịch chất điện li thì
A. Cả Pb và Sn đều bị ăn mòn điện hóa
B. Cả Pb và Sn đều không bị ăn mòn điện hóa
C. Chỉ có Pb bị ăn mòn điện hóa
D. Chỉ có Sn bị ăn mòn điện hóa
- Câu 42 : Có 4 dung dịch riêng biệt: CuSO4, ZnCl2, FeCl3, AgNO3. Nhúng vào mỗi dung dịch một thanh Ni. Số trường hợp xuất hiện ăn mòn điện hoá là
A. 2
B. 3
C. 4
D. 1
- Câu 43 : Trường hợp nào dưới đây, kim loại không bị ăn mòn điện hóa?
A. Đốt Al trong khí Cl2
B. Để gang ở ngoài không khí ẩm
C. Vỏ tàu làm bằng thép neo đậu ngoài bờ biển
D. Fe và Cu tiếp xúc trực tiếp cho vào dung dịch HCl
- Câu 44 : Tiến hành các thí nghiệm sau:
A. 3
B. 2
C. 1
D. 4
- Câu 45 : Phát biểu nào dưới đây không đúng?
A. Nguyên tắc chung để điều chế kim loại là khử ion kim loại thành nguyên tử kim loại.
B. Bản chất của ăn mòn kim loại là quá trình oxi hóa - khử
C. Tính chất hóa học đặc trưng của kim loại là tính khử
D. Ăn mòn hóa học phát sinh dòng điện
- Câu 46 : Trường hợp nào sau đây kim loại bị ăn mòn điện hoá học?
A. Cho kim loại Zn nguyên chất vào dung dịch HCl
B. Cho kim loại Cu nguyên chất vào trong dung dịch HNO3 loãng
C. Thép cacbon để trong không khí ẩm
D. Đốt dây sắt nguyên chất trong khí O2
- Câu 47 : Khi vật bằng gang, thép bị ăn mòn điện hóa trong không khí ẩm, nhận định nào sau đây là nhận định đúng:
A. Tinh thể cacbon là cực âm xảy ra quá trình oxi hóa
B. Tinh thể cacbon là cực dương, xảy ra quá trình oxi hóa
C. Tinh thể sắt cực dương xảy ra quá trình khử
D. Tinh thể sắt là cực âm xảy ra quá trình oxi hóa
- Câu 48 : Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
A. Đốt dây sắt trong khí oxi khô
B. Kim loại sắt trong dung dịch HNO3 loãng
C. Kim loại kẽm trong dung dịch HCl
D. Thép cacbon để trong không khí ẩm
- Câu 49 : Ngâm một lá Zn tinh khiết trong dung dịch HCl, sau đó thêm vài giọt dung dịch CuSO4 vào. Trong quá trình thí nghiệm trên
A. chỉ xảy ra hiện tượng ăn mòn điện hóa học
B. lúc đầu xảy ra hiện tượng ăn mòn điện hóa học sau đó xảy ra thêm hiện tượng ăn mòn hóa học
C. lúc đầu xảy ra hiện tượng ăn mòn hóa học sau đó xảy ra thêm hiện tượng ăn mòn điện hóa học
D. Chỉ xảy ra hiện tượng ăn mòn hóa học
- Câu 50 : Nếu vật làm bằng hợp kim Fe-Zn bị ăn mòn điện hoá thì trong quá trình ăn mòn
A. sắt đóng vai trò anot và bị oxi hoá
B. kẽm đóng vai trò anot và bị oxi hoá
C. sắt đóng vai trò catot và ion H+ bị oxi hóa
D. kẽm đóng vai trò catot và bị oxi hóa
- Câu 51 : Trường hợp nào sau đây xảy ra ăn mòn điện hoá?
A. Sợi dây bạc nhúng trong dung dịch HNO3
B. Đốt lá sắt trong khí Cl2
C. Thanh nhôm nhúng trong dung dịch H2SO4 loãng
D. Thanh kẽm nhúng trong dung dịch CuSO4
- Câu 52 : Tiến hành các thí nghiệm sau đây:
A. 2
B. 5
C. 3
D. 4
- Câu 53 : Phương pháp thích hợp điều chế kim loại Mg từ MgCl2 là
A. điện phân dung dịch MgCl2
B. điện phân MgCl2nóng chảy
C. nhiệt phân MgCl2
D. dùng K khử Mg2+trong dung dịch MgCl2
- Câu 54 : Hai kim loại có thể điều chế bằng phương pháp nhiệt luyện là
A. Ca và Fe
B. Mg và Zn
C. Na và Cu
D. Fe và Cu
- Câu 55 : “Ăn mòn kim loại” là sự phá huỷ kim loại do:
A. Tác dụng hoá học của môi trường xung quanh
B. Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng diện
C. Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao
D. Tác động cơ học
- Câu 56 : Để chống ăn mòn cho đường ống dẫn dầu bằng thép chôn dưới đất, người ta dùng phương pháp điện hoá. Trong thực tế, người ta dùng kim loại nào sau đây làm điện cực hi sinh?
A. Zn
B. Sn
C. Cu
D. Na
- Câu 57 : Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe và Ni. Khi nhúng các cặp kim loại trên vào dung dịch axit, số cặp kim loại trong đó Fe bị phá huỷ trước là
A. 1
B. 3
C. 2
D. 4
- Câu 58 : Kim loại M bị ăn mòn điện hoá học khi tiếp xúc với sắt trong không khí ẩm. M có thể là
A. Bạc
B. Đồng
C. Chì
D. Kẽm
- Câu 59 : Trường hợp xảy ra ăn mòn điện hóa là
A. Nhúng thanh Fe vào dung dịch chứa hỗn hợp H2SO4 loãng và lượng nhỏ CuSO4
B. Nhúng thanh Fe vào dung dịch hỗn hợp Fe2(SO4)3 và H2SO4 loãng
C. Nhúng thanh Fe vào dung dịch Fe2(SO4)3
D. Nhúng thanh Fe vào dung dịch H2SO4 loãng
- Câu 60 : Kim loại nào sau đây có tính khử mạnh nhất?
A. Fe
B. K
C. Mg
D. Al
- Câu 61 : Cho các nửa phản ứng:
A. 4
B. 5
C. 6
D. 3
- Câu 62 : Ở nhiệt độ cao, khí CO khử được các oxit nào sau đây:
A. Fe2O3 và CuO
B. Al2O3 và CuO
C. MgO và Fe2O3
D. CaO và MgO
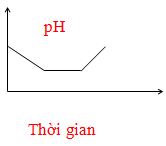
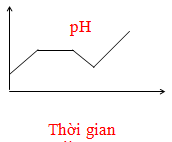
- Câu 63 : Điện phân dung dịch chứa HCl, NaCl, FeCl3 (điện cực trơ, có màng ngăn). Đồ thị nào sau đây biểu diễn đúng sự biến thiên pH của dung dịch theo thời gian (bỏ qua sự thuỷ phân của muối)?
A.
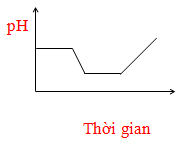
B.
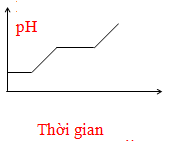
C.
D.
- Câu 64 : Cho 2,24 lit đktc khí CO đi từ từ qua một ống sứ nung nóng chứa m gam hỗn hợp MgO, Fe2O3, CuO. Sau phản ứng thu được (m - 0,8) gam chất rắn và hỗn hợp khí X. Tính tỷ khối hơi của X so với H2.
A. 14
B. 18
C. 12
D. 24
- Câu 65 : Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4; 0,12 mol Fe2(SO4)3 và 0,44 mol NaCl bằng dòng điện có cường độ 2 ampe. Thể tích khí (đktc) thoát ra ở anoot sau 26055 giây điện phân là:
A. 5,936 lít
B. 9,856 lít
C. 5,488 lit
D. 4,928 lit
- Câu 66 : Cho Fe phản ứng với dd HNO3 đặc, nóng thu được một chất khí màu nâu đỏ. Chất khí đó là:
A. N2
B. NH3
C. NO2
D. N2O
- Câu 67 : Có thể dùng axit nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Cu, Ag?
A. HCl
B. HNO3 loãng
C. H2SO4 loãng
D. H2SO4 đặc nguội
- Câu 68 : Cho sơ đồ sau:
A. 3
B. 4
C. 5
D. 6
- Câu 69 : Phương trình phản ứng nào sau đây viết sai?
A.
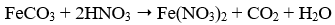
B.
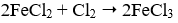
C.
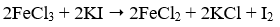
D.
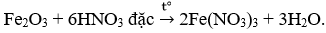
- Câu 70 : Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng dư chất nào sau đây?
A. Mg
B. Cu
C. Ba
D. Na
- Câu 71 : Nguyên tử 23Z có cấu hình e là: 1s22s22p63s1. Z có
A. 11 nơtron, 12 proton
B. 11 proton, 12 nơtron
C. 13 proton, 10 nơtron
D. 11 proton, 12 electron
- Câu 72 : Cho sơ đồ sau:
A. FeS, Fe2O3, FeO
B. Fe3O4, Fe2O3, FeO
C. Fe2O3, Fe3O4, FeO
D. FeO, Fe3O4, Fe2O3
- Câu 73 : Có thể dùng dung dịch muối nào sau đây để hòa tan hoàn toàn hỗn hợp gồm: Al, Fe, Pb, Cu?
A. Cu(NO3)2
B. Pb(NO3)2
C. AgNO3
D. Al(NO3)3
- Câu 74 : Chất nào sau đây có thể oxi hóa Zn thành Zn2+?
A. Fe
B. Ag+
C. Al3+
D. Ca2+
- - Trắc nghiệm Hóa học 12 Bài 2 Lipit
- - Trắc nghiệm Hóa học 12 Bài 3 Khái niệm về Xà phòng và Chất giặt rửa tổng hợp
- - Trắc nghiệm Hóa học 12 Bài 4 Luyện tập Este và Chất béo
- - Trắc nghiệm Hóa học 12 Bài 5 Glucozơ
- - Trắc nghiệm Hóa học 12 Bài 6 Saccarozơ, Tinh bột và Xenlulozơ
- - Trắc nghiệm Hóa học 12 Bài 7 Luyện tập Cấu tạo và tính chất của Cacbohidrat
- - Trắc nghiệm Hóa học 12 Bài 9 Amin
- - Trắc nghiệm Hóa học 12 Bài 10 Amino axit
- - Trắc nghiệm Hóa học 12 Bài 11 Peptit và Protein
- - Hóa học 12 Bài 12 Luyện tập Cấu tạo và tính chất của Amin, Amino axit và Protein

