Bài 3 tính chất hóa học của axit
Bài 3 tính chất hóa học của axit
Trong bài viết này Cunghocvui sẽ giới thiệu tới các bạn một nội dung học rất quan trọng và bổ ích về tính chất hóa học của axit lớp 9!
I. Lý thuyết
Axit là một hợp chất hóa học quan trọng có khả năng tan trong thường và do đặc tính axit nên thường có vị chua. Công thức tổng quát cho axit được ký hiệu là HxA.
1. Đặc tính vật lý
- Độ pH của axit nhỏ hơn 7 và thường có vị chua.
- pH càng nhỏ dẫn đến độ axit càng mạnh và hòa tan trong nước.
- Thực chất, có rất nhiều chất có tính axit nhưng lại không phải là axit như oxit axit.
2. Tính chất hóa học
- Axit làm đổi màu quỳ từ tím sang màu đỏ hoặc màu hồng
- Phản ứng tương quan với kim loại tạo ra sản phẩm và muối và giải phóng khí H2. Chỉ các nguyên tố kim loại đủ mạnh, đứng trước hidro trong dãy hóa học mới có khả năng đẩy H ra khỏi dung dịch axit.
Ví dụ: \({\displaystyle { {Mg +2HCl \to MgCl_2 +H_2}}}\)
Đối với riêng phản ứng tác dụng với axit sunfuric sẽ tạo ra các sản phẩm muối của lưu huỳnh đioxit và khí H2.
- Trong phản ứng tương quan với bazơ ta sẽ cho ra sản phẩm là muối trung hòa, muối axit, muối bazơ và nước xúc tác.
Ví dụ:
\({\displaystyle { {Ba(OH)_2 +H_2SO_4 \to BaSO_4 +2H_2O}}}\)
\({\displaystyle { {Cu(OH)_2 +H_2SO_4 \to CuSO_4 +2H_2O}}}\)
- Trong phản ứng tương quan với oxit bazơ cũng gần như tương tự tính chất trên, ta sẽ cho ra sản phẩm là muối trung hòa, muối axit, muối bazơ và nước xúc tác
Ví dụ:
\({\displaystyle { {CuO +2HCl \to CuCl_2 +H_2O}}}\)
- Tác dụng với muối (tạo axit mới và muối mới)
Ví dụ:
\({\displaystyle { {CaCl_2 +H_2SO_4 \to CaSO_4 +2HCl}}}\)
3. Tính điện li
Phản ứng điện li đặc biệt diễn ra theo cơ chế, khi axit kết hợp với nước thì phản ứng sẽ diễn ra bình thường do lúc này nước thay thế vai trò như một bazơ:
\({\displaystyle { {HA +H_2O \to A^- +H_3O^+}}}\)
Hằng số điện li được tính dựa trên công thức dưới đây, khi đó ta dùng hằng số để cân bằng phản ứng hóa học diễn ra:
\({\displaystyle K_{a}={[A^{-}]\cdot [{\mbox{H}}_{3}{\mbox{O}}^{+}] \over [HA]}}\)
Tính mạnh của axit tỉ lệ thuận so với hệ số điện li, axit càng mạnh thì K càng lớn (trong thực tế kiểm nghiệm được cho thấy hầu hết các axit gần như điện li hoàn toàn.
4. Phản ứng trung hòa
Phản ứng xảy ra khi cho axit tác dụng với bazơ. Kết quả thu được sản phẩm là muối và nước.
\({\displaystyle { {NaOH +HCl \to NaCl +H_2O}}}\)
II. Sơ đồ tư duy tính chất hóa học của axit
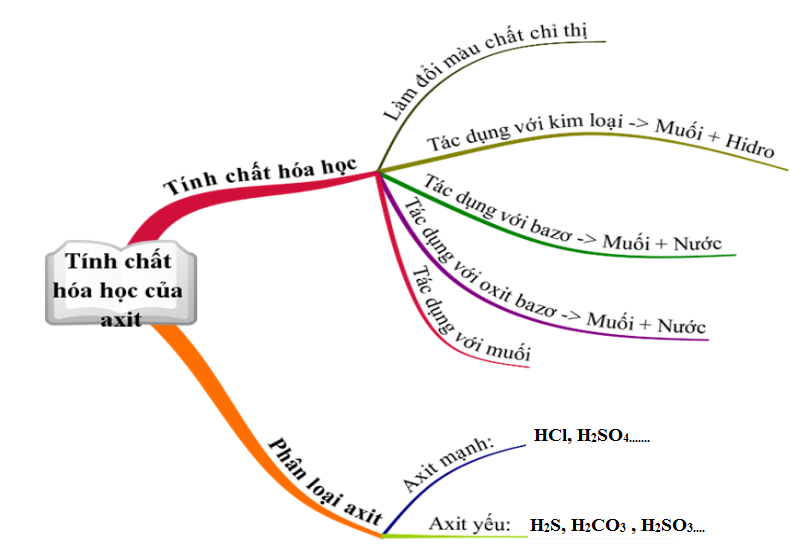
III. Bài tập vận dụng
1. Tự luận
Bài 1: Phân biệt các chất sau đây bằng các phản ứng hóa học.
MgCl2, CuO, Fe2O3, Al2O3
a. Khí hiđro khá nhẹ và dễ dàng bị bốc cháy khi gặp môi trường có nhiệt độ cao.
Mg + 2HCl → MgCl2 + H2↑
b. Vì phản ứng tạo ra dung dịch muối của Cu nên có hiện tượng xảy ra là: xuất hiện kết tủa màu xanh lam.
CuO + 2HCl → CuCl2 + H2O
c. Phản ứng xảy ra dung dịch có màu vàng, hơi nâu ở đây có thể là Fe(OH)3 hoặc Fe2O3
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d. Dung dịch không màu: dung dịch MgCl2 hoặc AICI3
AI2O3 + 6HCl → 2AICI3 + 3H20
Bài 2: Lấy ví dụ về các phản ứng đặc trưng của axit:
a. Magie oxit và axit nitric:
MgO + 2HNO3 → Mg(NO3)2+ H2O
b. Đồng (II) oxit và axit clohiđric:
CuO + 2HCl → CuCl2 + H2O
c. Nhôm oxit và axit sunfuric:
AI2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
d. Sắt và axit clohiđric:
Fe + 2HCl → FeCl2 + H2↑
e. Kẽm và axit sunfuric loãng:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑
2. Trắc nghiệm
Câu 1. Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphatalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện
D. Màu xanh từ từ xuất hiện
Câu 2. Cho một mẫu giấy quì tím vào dung dịch NaOH. Thêm từ từ dung dịch HCl vào cho đến khi dư ta thấy màu giấy quì:
A. Màu đỏ không thay đổi
B. Màu đỏ chuyển sang dần màu xanh
C. Màu xanh không đổi
D. Màu xanh chuyển dần sang đỏ
Câu 3. Cho 300 mol dung dịch HCl 1M vào 300 mol dung dịch NaOH 0,5M. Nếu cho quì tím vào dung dịch sau phản ứng thì quì tím chuyển sang :
A. Màu xanh
B. Không đổi màu
C. Màu đỏ
D. Màu vàng nhạt
Câu 4. Khi trộn lẫn dung dịch X chứa 1 mol HCl vào dung dịch Y chứa 1,5 mol NaOH được dung dịch Z. Dung dịch Z làm quì tím chuyển sang:
A. Màu đỏ
B. Màu xanh
C. Không màu
D. Màu tím
Câu 5. Cho phản ứng:
BaCO3 + 2X → H2O + Y + CO2
X và Y lần lượt là:
A. H2SO4 và BaSO4
B. HCl và BaCl2
C. H3PO4 và Ba3(PO4)2
D. H2SO4 và BaCl2
Câu 6. Trung hòa 200 ml dung dịch H2SO4 1M bằng 200 gam dung dịch NaOH 10%. Dung dịch sau phản ứng làm quì tím chuyển sang:
A. Đỏ
B. Vàng nhạt
C. Xanh
D. Không màu
Câu 7. Dung dịch A có pH < 7 vào tạo kết tủa khi tác dụng với dung dịch bari nitrat Ba(NO3)2. Chất A là:
A. HCl
B. Na2SO4
C. H2SO4
D. Ca(OH)2
Câu 8. Thuốc thử dùng để nhận biết: HNO3; Ba(OH)2; NaCl; NaNO3 đựng riêng biệt trong các lọ mất nhãn là:
A. Dùng quì tím và dung dịch Ba(NO3)2
B. Dùng dung dịch phenolphtalein và dung dịch AgNO3
C. Dùng quì tím và dung dịch AgNO3
D. Dùng dung dịch phenolphtalein và dung dịch Ba(NO3)2
Câu 9. Dùng thuốc thử nào sau đây để nhận biết các chất chứa trong các ống nghiệm mất nhãn: HCl; KOH; NaNO3; Na2SO4
A. Dùng quì tím và dung dịch CuSO4
B. Dùng dung dịch phenolphatalein và dung dịch BaCl2
C. Dùng quì tím và dung dịch BaCl2
D. Dung dung dịch phenolphatalein và dung dịch H2SO4
Câu 10. Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit sunfuric. Thể tích khí hiđro thu được ở đktc là:
A. 44,8 lít
B. 4,48 lít
C. 2,24 lít
D. 22,4 lít
Câu 11. Cho 0,1 mol kim loại kẽm vào dung dịch HCl dư, khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Câu 12. Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
A. 2, 5 lít
B. 0,25 lít
C. 3,5 lít
D. 1,5 lít
Câu 13. Cho 0,2 mol CaO tác dụng với 500 ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g
B. 22,2 g
C. 23,2 g
D. 22,3 g
Câu 14. Hòa tan 16 gam SO3 trong nước thu được 250 ml dung dịch axit. Nồng độ của dung dịch thu được là:
A. 0,2M
B. 0,4M
C. 0,6M
D. 0,8M
Câu 15. Khi cho 500 ml dung dịch NaOH 1 M tác dụng hết với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
A. 250 ml
B. 400 ml
C. 500 ml
D. 125 ml
Câu 16. Cho 10,5 gam hỗn hợp hai kim loại Zn và Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 63% và 37%
C. 61,5% và 38,5%
D. 65% và 35%
Câu 17. Hòa tan hết 4,6 gam Na vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là:
A. 100 ml
B. 200 ml
C. 300 ml
D. 400 ml
Câu 18. Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. Khối lượng dung dịch NaOH cần dùng là:
A. 100 g
B. 80 g
C. 90 g
D. 150 g
Câu 19. Để trung hòa 112 gam dung dịch KOH 25% thì cần bao nhiêu gam dung dịch axit sunfuric 4,9%
A. 400g
B. 500g
C. 420 g
D. 570 g
Câu 20. Cho 100 ml dung dịch H2SO4 2M tác dụng với 100 ml dung dịch Ba(NO3)2 1M. Nồng độ mol của dung dịch sau phản ứng lần lượt là:
A. H2SO4 1M và HNO3 0,5 M
B. BaSO4 0,5M và HNO3 1M
C. HNO3 0,5 M và Ba(NO3)2 0,5M
D. H2SO4 0,5M và HNO3 1M
Câu 21. Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe3O3 trong 200 ml dung dịch HCl 3,5M. Khối lượng mỗi oxit trong hỗn hợp là:
A. 4 g và 16 g
B. 10 g và 10 g
C. 8 g và 12 g
D. 14 g và 6 g
Câu 22. Hòa tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400 ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Câu 23. Cho 100 ml dung dịch Ba(OH)2 1M vào 100 ml dung dịch H2SO4 0,8M. Khối lượng kết tủa thu được là:
A. 23,30 g
B. 18,64 g
C. 1,86 g
D. 2,33 g
ĐÁP ÁN
| 1C | 2D | 3C | 4B | 5B | 6C | 7C | 8C | 9C | 10B |
| 11A | 12B | 13B | 14D | 15D | 16A | 17B | 18B | 19B | 20D |
| 21C | 22A | 23B |
Hy vọng rằng với những kiến thức mới về nêu tính chất hóa học của axit trên đây, sẽ giúp các bạn hoàn toàn có thể nắm chắc một cách dễ dàng và có những giờ học thư giãn!

